2004 年江苏南京农业大学化学考研真题
无机化学部分(75 分)
一、单选题(每题二分)
1.0.
1mol/Kg 的下列物质溶液沸点大小顺序是
A
C
NaCl
ZnCl
AICl
3
2
NaCl
AICl
3
ZnCl
2
B
D
AICl
3
ZnCl
2
NaCl
NaCl
ZnCl
AICl
3
2
B 多相,比较稳定,粒子不能通过半透膜
2. 以下关于溶胶的叙述,正确的是
A.均相,稳定,粒子能通过半透膜
C 均相,比较稳定,粒子能通过半透膜 D 多相,稳定,粒子不能通过半透膜
3. 乙醇,丙酮能使高分子溶液聚沉,原因是
A 它们有强烈亲水性
C 它们使高分子化合物失去电荷
4. 关于自发反应以下说法正确的是
A 自发反应是放热反应
C 自发反应是吸热反应
5. 恒压下,某反应 A(s)+B(g)=2C(g)为放热反应,则反应体系的
A ΔU>0,W>0
B 自发反应在一定条件下可达平衡
D 自发反应是可逆反应
B 它们不溶解高分子化合物
D 它们本身可以电离
C ΔU<0,W<0
D ΔU<0,W>0
B ΔU>0,W<0
6. 标准状态时下列哪一物质的
G
m
,
f
f
,
SH
m
m
都是 0
B 金属 Ca
C H 离子 D OH 离子
A 氧气
7. 催化剂不能改变的是
A 正反应速度 B 逆反应速度 C 反应活化能 D 反应自由能
8. 勒夏特列原理适用于
A 等容体系 B 开放体系 C 孤立体系 D 平衡体系
9. 反应
CO
2
步骤是
)(
)(
gHg
2
)(
gOHgCO
)(
2
等容条件下,对于水的摩尔质量有影响的
A 降低温度 B 降低压力 C 增加压力 D 加入氮气
10. 根据稀释定律和解离度成正比关系的是
A 浓度 c
B
c
C Ka
D Ka
11. 下列溶液 pH 值最大的是
A
0.10mol/LHAc
B
0.010mol/LHCl
C
0.10mol/LNH4Cl
D 0.00010mol/LHCl
12. 实验测定 100ml0.01mol/L
NaNO 水溶液的 pH 值是 8.0,则
2
HNO2
为的Ka
A
12
10
B
810
C
610
D
410
13. 溶液中,当
K
SP
(
Ag
CO
3
2
)
C
2
Ag
C
CO
3
1.8
10
12
时可以说明的是
�
A 银离子浓度是碳酸根的二倍 B Ag2CO3 不容易电离 C 溶液是 Ag2CO3 的饱和溶液 D 银离
子浓度等于碳酸根浓度
14.某难溶电解质 AB2 的饱和溶液中
2
[
A
]
xmol
/
[,
BL
]
ymol
/
是其
spKL
A
yx
B
2yx
C
x
2)2( y
D
5.0 xy
2
15.按氧化还原方程式可以写出或查出反应自由能,热效应,平衡常数和电动势,其中和方
程式写法无关的是
A
E(电动势) B
rG
C
rH
D
K
16..已知
E
IOH
6
5
/
I
37.0
IOHV
,
5
70.0
V
HIO
3
6
HIO
45.0
V
I
2
54.0
V
I
则
A
IO
IOE /3
0.30V
B
0.21V
C
0.18V
D
0.14
17.已知
K
sp
(
ZnS
)
K
sp
(
CuS
则)
A
C
E
/
S
CuS
E
/
SS
2
E
/
S
ZnS
E
/
SS
2
E
/
S
ZnS
E
/
S
CuS
B
D
E
/
S
CuS
E
/
S
ZnS
E
/
SS
2
E
/
S
ZnS
E
/
SS
2
E
/
S
CuS
D
Bohr
Planck
Einstein
de Broglie
18.提出微观粒子有波粒二象性的是
A
19.关于波函数ψ说法正确的是
A 一种原子有一种波函数 B 一种波函数对应电子一种运动状态 C 波函数有明确物理意
义 D. 波函.数代表电子在某处出现的概率
20.已知某元素在序号 36 前,此元素失去三个电子后,它的角量子数为二的轨道内电子恰好
半充满,此元素序号为
A
21.产生能级分裂现象的主要原因是
A 屏蔽效应和钻穿效应 B Pauli 不相容原理 C Slater 规则 D 能量最低原理
28
25
26
27
C
D
B
B
C
22.钼原子外层电子排布是
4
d
1
55
s
,这样排布的主要依据是
Hund 规则 C
Slater 规则 B
Pauli 不相容原理 D. 能量最低原理
A
23.二个具有单电子的原子互相靠近,可能形成共价键的条件是
A 二电子自旋方向不同 B 二电子能量相近 C 二电子自旋量子数相同 D 二电子波
函数相同
24.氨水溶液中氨分子之间的作用力有
A 一种
C 三种
B 二种
D 四种
25.螯合物比相应简单配位物稳定的本质是
A 热效应 B 形成多元环 C 熵效应 D 螯合效应
二、计算题(每小题 5 分)
�
1. 0.50mol/L 水在其沸点气化,恒压汽化热 2.26kJ/g,求 W,Q,ΔU,ΔH 和ΔG.
2.
PCl
5
)(
g
PCl
)(
g
)(
gCl
2
3
已知 100
apK ,523K 时 Kp=1.6,求
(1) 总压力 1000
apK 时 PCl5 的摩尔分解率
(2) 如果摩尔分解率为 10%,此时总压力多少
3.0.10mol/L 的 HAc 和 0.050mol/LNaOH 等体积混合,计算溶液中
OH 3
Ac
离
子浓度
(
Ka
77.1
510
)
4.反应
)(
gCO
)(
sC
1
2
)(
2 gO
fH m
( mol
ki
/
)
-110.52
0
0
S m
(
J
mol
1
k
1
)
197.67
5.74
205.14
根据以上热力学数据计算反应自由能并判断其自发性.
5.已知反应
2
NaHCO
rG
m
NH
HCO
4
rG
m
)(
S
3
19.28
)(
g
22.28
3
KJ
KJ
Na
CO
2
/
mol
NH
3
/
mol
)(
)(
gOHg
2
)(
)(
gOHs
2
CO
2
)(
g
3
CO
2
)(
g
计算当 298K 时,
NaHCO
3,
Na
CO
3
2
和
NH
4
HCO
3
共存时氨的分压
可能用到的公式:
WQU
STH
G
G
r
G
m
r
RTIn
a
a
e
E
b
B
a
a
f
F
d
D
r
[
H
G
]
RTInK
CKa
有机化学部分(75 分)
一、选择一个正确答案填入下列括号内(每题 1 分,共 20 分)
1.水中溶解度最大的是
(
)
A.HO(CH2)3OH
B.C2H5OCH(CH3)2
�
C.CH3CH2CH2CH2OH
D.CH3CHO
2.乙酰乙酸乙酯能使溴水褪色是因为存在
(
)
A.对映异构
C.构象异构
B.顺反异构
D.互变异构
3.皂化值越大,油脂平均相对分子质量
A.越大
B.越小
C.不受影响
4.最稳定的游离基是
A.(CH3)3C
C.CH3CH2
B.(CH3)2CH
D.CH3
(
)
(
)
5.具有相同分子式的外消旋体与内消旋体之间是
(
)
A.对映异构
C.差相异构
B.非对映异构
D.互变异构
6.下列化合物中,与氢氰酸反应活性顺序排列正确的是
(
)
(1)CH3CH3CHO(2)HCHO(3)C6H5COCH3(4)C6H5CHO
A.2>1>4>3
C.1>2>3>4
B.2>1>3>4
D.1>2>4>3
7.下列四种化合物中没有芳香性的是
(
)
A.六氢吡啶
C.环丙烯正离子
B.吡咯
D.-甲基呋喃
8.苹果酸失水时生成的产物是
(
)
A.顺丁烯二酸
C.琥珀酸
B.反丁烯二酸
D.酒石酸
9.在合成乙酰苯胺实验中,加入少量锌粉的目的是
(
)
A.防止苯胺氧化
B.防止乙酰苯胺分解
C.作为催化剂
10.甲苯在光照或高温下与氯气的反应属于
(
)
A.亲电取代反应
C.亲电加成反应
B.亲核取代反应
D.自由基反应
11.赖氨酸的 pI=9.74,它在 pH 为 2.7 的溶液中主要呈
(
)
A.正离子
B.中性分子
�
C.负离子
D.两性离子
12.与 D-葡萄糖生成相同糖脎的是
(
)
A.麦芽糖
C.D-核糖
B. L-甘露糖
D.D-果糖
13.能把伯、仲、叔胺分离开的试剂为
(
)
A.斐林试剂
B.硝酸银的乙醇溶液
C.苯磺酰氯的氢氧化钠溶液
D.碘的氢氧化钠溶液
14.组成蛋白质的氨基酸结构特点是
(
)
A.L 型、-氨基酸
C. L 型、-氨基酸
B. D 型、-氨基酸
D. D 型、-氨基酸
15.内消旋酒石酸的构型是
(
)
A. 2S,3R
C. 2S,3S
B. 2R,3R
D. 2R,3S
16.下列脂肪酸中,属于不饱和脂肪酸的是
(
)
A.硬脂酸
C.油酸
B.十二烷酸
D.软脂酸
17. 重结晶进行热过滤时,采用折叠滤纸的目的是
(
)
A.扩大过滤面积、加快过滤速度
B.过滤更容易进行
C.除去活性炭
18.常压蒸馏沸点在 140C 以上的物质时,选用的冷凝管为
(
)
A.直型冷凝管
C.球型冷凝管
B.蛇型冷凝管
D.空气冷凝管
19. 抽气过滤时,选用的漏斗是
(
)
A.玻璃漏斗
C.布氏漏斗
B.热水漏斗
D.砂芯漏斗
20. 固体有机化合物纯化的方法通常采用的是
(
)
A.重新蒸馏
B.重结晶
C.重新过滤
二、写出下列化合物的结构简式(每题 1 分,共 8 分)
1. 乙基--D-核糖苷
2. 甘油三硝酸酯
3. 2Z,4Z-己二烯酸
4. 对羟基氯化重氮苯
�
5. 氢氧化四甲基铵
7. 尿嘧啶
6. 水扬酸
8. D-半胱氨酸
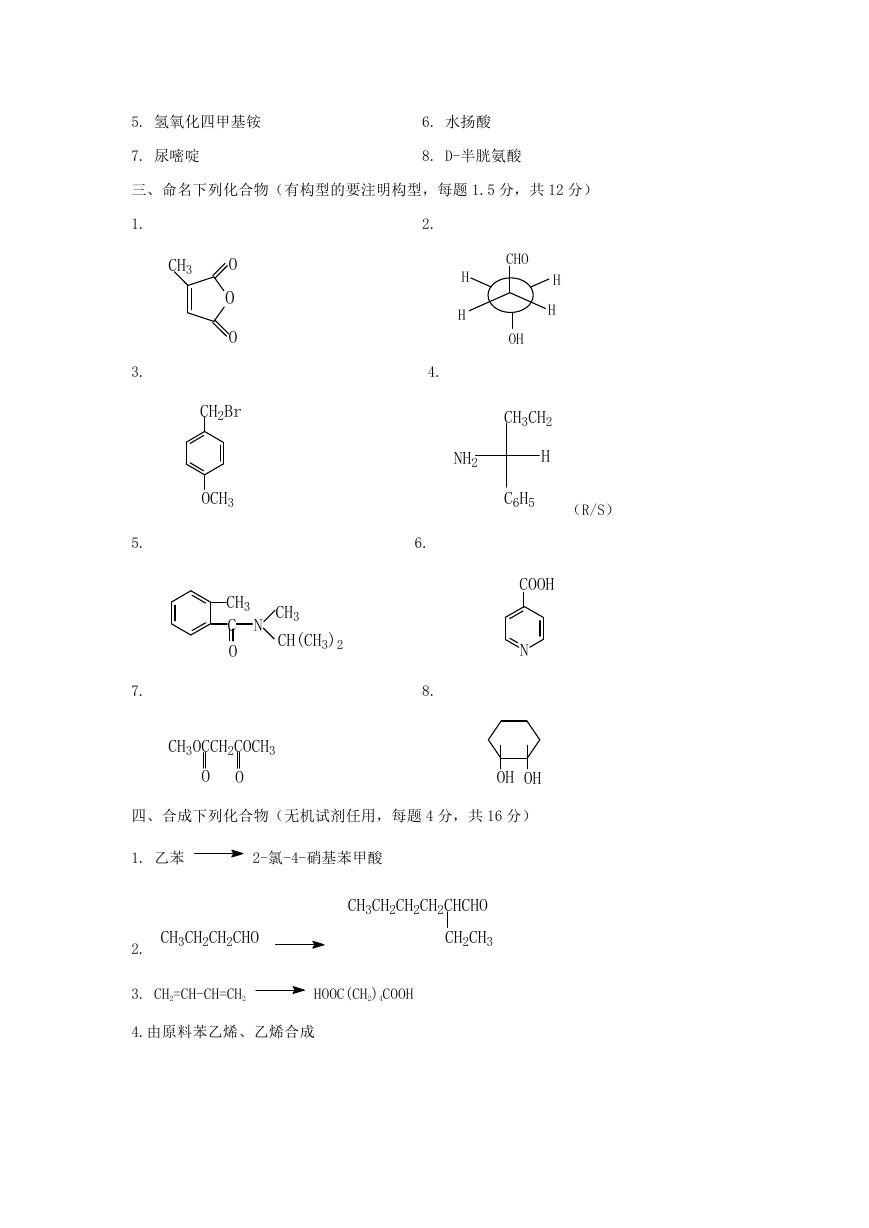
三、命名下列化合物(有构型的要注明构型,每题 1.5 分,共 12 分)
1.
3.
5.
7.
CH3
O
O
O
CH2Br
OCH3
CH3
C
N
O
CH3
CH(CH3)2
CH3OCCH2COCH3
O
O
2.
4.
H
H
CHO
OH
H
H
CH3CH2
NH2
H
C6H5
(R/S)
6.
8.
COOH
N
OH
OH
四、合成下列化合物(无机试剂任用,每题 4 分,共 16 分)
1. 乙苯
2-氯-4-硝基苯甲酸
CH3CH2CH2CHO
2.
CH3CH2CH2CH2CHCHO
CH2CH3
3. CH2=CH-CH=CH2
HOOC(CH2)4COOH
4.由原料苯乙烯、乙烯合成
�
CH
OCH2
OCH2
五、区别下列各组化合物(共 7 分)
1. 淀粉溶液、蛋白质溶液、蔗糖溶液(3 分)
2. (4 分)
COOH
OH
NH2
NH2
六、推导结构(共 8 分)
某化合物分子式为 C6H12O,不能起银镜反应,但能与羟胺作用生成肟,在铂催化下加氢可
生成一种醇,该醇经脱水,臭氧化分解后,得到两种液体,其中之一能起碘仿反应,但不能
与斐林试剂反应,另一种则能起银镜反应,但不能起碘仿反应。试写出该化合物的结构式,
并写出相关化学反应式。
七、实验题(共 4 分)
以硫酸、溴化钠、乙醇为原料合成溴乙烷。得到的溴乙烷粗产物中可能有什么杂质?如
何除去?
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc