2007 年山东普通高中会考化学真题及答案
说明:本试题共分三卷,第 I 卷 4 页为必修内容的选择题,共 48 分;第Ⅱ卷 2 页为必
修内容的非选择题,共 28 分;第 I 卷和第Ⅱ卷为全体考生必做题。第Ⅲ卷为选修内容的非
选择题,共六个模块每个模块 24 分,考生只能任选一个模块作答,多选答者,按照模块呈
现的顺序首先作答的计分。考生所作答题目满分为 100 分,考试时间 90 分钟。
可能用到的相对原子质量:H1 C12
Na23
O16
第 I 卷(选择题 共 48 分)
N14
B 有机物
C 盐类
D 非金属单质
注意事项:
1、 答第 I 卷前务必将自己的姓名、考号、考试科目涂写在答题卡上。考试结束,试题和
答题卡一并收回。
2、第 I 卷每题选出答案后,都必须用 2B 铅笔把答题卡上对应的答案标号(ABCD)涂黑,
如需改动,必须先用橡皮擦干净,再改涂其它答案。
1、下列叙述正确的是
A 濒临大海的地区,碘资源丰富,不必食用加碘盐。
B 加碘食盐对人体有益,吃得越多越好。
C 天然物质都比人造物质好。
D 化学家可以制造物质,也可以创造新分子。
2、环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办
法。塑料袋、废纸、旧橡胶制品等属于
A 无机物
3、元素的化学性质主要决定于
B 核内质子数
A 核外电子数
C 核内中子数
D 最外层电子数
4、下列说法正确的是
A 棉花、羊毛、木材和草类的主要成分都是纤维类
B 乙醇是可再生能源,而且比汽油污染小,应大力推广“乙醇汽油
C 光导纤维非常细,导光能力非常强,能同时传输大量信息,光导纤维是由硅晶体制成的
D 工业制备硫酸的尾气中,常含有 SO2 等有害气体,如果直接排入大气,可能形成光化学烟
雾
5、下列离子方程式中正确的是
A、Cu(OH)2 与盐酸反应:H++OH-=H2O
B、MgSO4 溶液与 Ba(OH)2 溶液反应:SO4
C、CaCl2 与 Na2CO3 溶液反应:Ca 2++CO3
D、CaCO3 与稀盐酸反应:CO3
6、He 是重要的核原料,月球上含有大量的 He 原子。一个 He 原子的质量数为 3,含有 1 个
中子。那么,He 原子的结构示意图为
2-+Ba2+=BaSO4↓
2-= CaCO3↓
2-+2H+= H2CO3
A、
+3
2 3
B、
+2
1
C、
+3
2
D、
+2
2
7、吸入人体内的氧有 2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生
命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3) ,能消除人体内的活性氧,
由此推断 Na2SeO3 的作用是
�
A 作还原剂
B 作氧化剂
C 既作氧化剂又作还原剂
D 既不作氧化剂又不作还原剂
8、下列关于化学键的叙述中,正确的是
A 存在于原子之间,也存在于分子之间
B 两个原子之间的相互作用叫化学键
C 离子键是阴、阳离子之间的相互吸引力
D 化学键通常指的是相邻的两个或多个原子间的强烈的相互作用
9、在实验室中,下列药品保存不正确的是
A 浓硝酸盛放在棕色瓶中,密封保存
B 少量的钠保存在煤油中
C Na2O2 密封保存
D NaOH 溶液保存在磨口玻璃塞的试剂瓶中
10、实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
11、厨房中的化学知识很多,下面是有关厨房中的常见操作或者党见现象,其中不属于氧
化还原反应的是
A 烧菜用过的铁锅,经放置常出现红棕色斑迹
B 用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量。
C 用醋酸除去水垢[主要成分是 CaCO3、Mg(OH)2]
D 牛奶久置变质腐败
12、下列有关化学反应的说法中正确的是
A 化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
B 化学反应中的能量变化都表现为热量的变化
C 需要加热才能发生的反应一定是吸热反应
D 放热反应在常温下一定很容易发生
13、在 C(s)+CO2(g)
①增大压强②升高温度③通入 CO2④增加碳的质量⑤降低压强
2CO(g) 反应中,可使反应速率增大的措施是
�
D②③④
C②③④⑤
B①②③
A①②③④
14、下列说法不正确的是
A、物质的量是一个基本物理量,衡量物质所含微粒集体的多少
B、1molH2O 的质量等于 NA 个 H2O 分子的质量总和(NA 表示阿伏加德罗常数)
C、标准状况下,1mol 任何气体体积约为 22.4L
D、将 40gNaOH 溶解于 500mL 水中,所得溶液的物质的量浓度为 2mol·L-1
15、某化学兴趣小组欲研究 H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH 的性质,对于如何研究,
他们设计了两种研究方案:
方案:①将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
②将它们按照钠盐、钾盐、铁盐和其它化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是
A 常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有酸
溶液和盐溶液。
B 设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀
硝酸,沉淀不消失,则该溶液中可能含有 Ag+
C 按照方案①的分类,属于碱的有 Na2CO3、NaOH
D 这两组同学在研究物质性质时只使用了实验法、观察法
16、已知五种短周期元素的原子半径及主要化合价如下表:
元素代号
L
原子半径/nm
0.160
主要化合价 +2
M
0.143
+3
Q
0.102
+6,-2
R
0.089
+2
T
0.074
-2
下列叙述正确的是
A、L 与 Q 形成的化合物属于共价化合物
B、L、M 的单质与稀盐酸反应速率:M>L
C、T、Q 的氢化物常温常压下均为无色气体
D、M 的最高价氧化物的水化物具有两性
(非选择题 共 52 分)
第Ⅱ卷(非选择题
共 28 分)
注意事项:
1、第Ⅱ卷共 2 页,用钢笔或圆珠笔直接答在试卷上。
2、答卷前将密封线内的项目填写清楚。
得分 评卷人
17.(7 分)
(1) 据报道:2006 年 12 月 8 日在青岛的中、美、韩海底光缆合建项目正式签约,这条耗
资 5 亿美元的“跨太平洋高速”光缆主要成分是
(2) 在第十五届多哈亚运会的开幕式上,激动人心的圣火点燃仪式过后,重约 15 吨的
焰火礼花燃起,璀璨宏伟的焰火把现场的气氛推向高潮。这些美丽的火焰主要利用
了化学上的
元素的物质产生
的。
反应;其中黄色的火焰是由含
(3) 试举两例有水参加的氧化还原反应,写出化学方程式。要求:
①水既不做氧化剂又不做还原剂
②水只做氧化剂
。
。
�
得分 评卷人
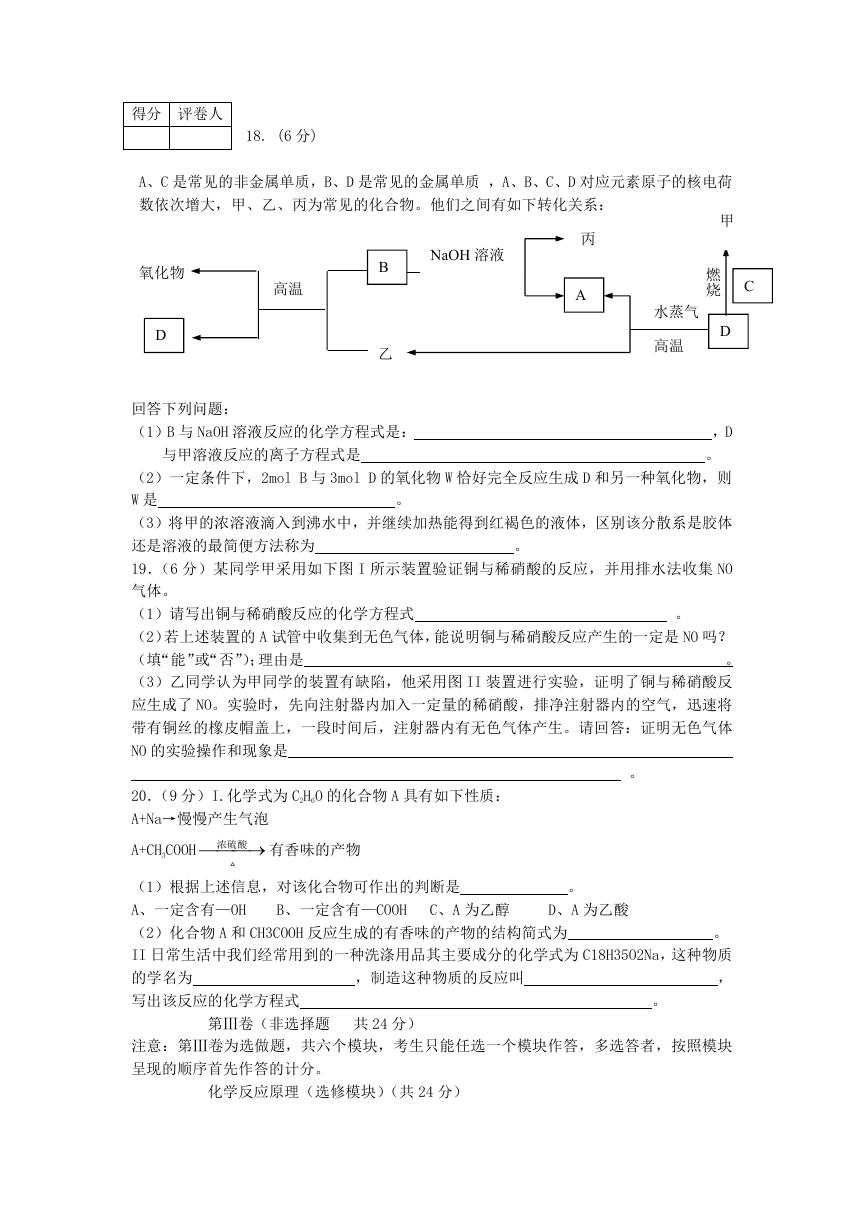
18. (6 分)
A、C 是常见的非金属单质,B、D 是常见的金属单质 ,A、B、C、D 对应元素原子的核电荷
数依次增大,甲、乙、丙为常见的化合物。他们之间有如下转化关系:
NaOH 溶液
丙
A
氧化物
D
高温
B
乙
回答下列问题:
(1)B 与 NaOH 溶液反应的化学方程式是:
与甲溶液反应的离子方程式是
甲
燃
烧 C
水蒸气
高温
D
,D
。
。
。
(2)一定条件下,2mol B 与 3mol D 的氧化物 W 恰好完全反应生成 D 和另一种氧化物,则
W 是
(3)将甲的浓溶液滴入到沸水中,并继续加热能得到红褐色的液体,区别该分散系是胶体
还是溶液的最简便方法称为
19.(6 分)某同学甲采用如下图 I 所示装置验证铜与稀硝酸的反应,并用排水法收集 NO
气体。
(1)请写出铜与稀硝酸反应的化学方程式
(2)若上述装置的 A 试管中收集到无色气体,能说明铜与稀硝酸反应产生的一定是 NO 吗?
(填“能”或“否”);理由是
(3)乙同学认为甲同学的装置有缺陷,他采用图 II 装置进行实验,证明了铜与稀硝酸反
应生成了 NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将
带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。请回答:证明无色气体
NO 的实验操作和现象是
。
。
20.(9 分)I.化学式为 C2H6O 的化合物 A 具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH
浓硫酸 有香味的产物
。
B、一定含有—COOH
(1)根据上述信息,对该化合物可作出的判断是
A、一定含有—OH
(2)化合物 A 和 CH3COOH 反应生成的有香味的产物的结构简式为
。
II 日常生活中我们经常用到的一种洗涤用品其主要成分的化学式为 C18H35O2Na,这种物质
的学名为
,
写出该反应的化学方程式
,制造这种物质的反应叫
D、A 为乙酸
C、A 为乙醇
。
。
第Ⅲ卷(非选择题 共 24 分)
注意:第Ⅲ卷为选做题,共六个模块,考生只能任选一个模块作答,多选答者,按照模块
呈现的顺序首先作答的计分。
化学反应原理(选修模块)(共 24 分)
�
21.(8 分)如图,水槽中试管内有一枚铁钉,放置数天观察。请回答下列
问题:
(1)若试管内液面上升,则原溶液呈现
发生
(2)若试管内液面下降,则原溶液呈现
发生
腐蚀,电极反应:负极:
22.(10 分)下列反应在 210℃达到平衡:
腐蚀,电极反应:正极:
性,
性,
;
。
①PCl5(g)
PCl3(g)+Cl2(g) △H1<0
K=1
②CO(g)+Cl2(g)
COCl2(g) △H2>0
K=5×104
③COCl2(g)
CO(g)+Cl2(g) △H3<0
;
(1)根据反应①的平衡常数 K 表达式,下列等式必定成立的是
A、 c(PCl5)=c(PCl3)=c(Cl2)=1
B、 c(PCl5)=c(PCl3)·c(Cl2)=1
C、 c(PCl5)=c(PCl3)·c(Cl2)
反应②和反应③的平衡常数 K 表达式
(2)降低 Cl2 浓度,反应③的 K 值
(3)要使反应①和反应②的 K 值相等,应采取的措施是
A、反应①、②同时升温
23.(6 分)
(1)常温下,将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合,测得混合溶液的 PH=6,
则混合溶液中由水电离出的 c(H+)
“>”、“<”或“=”)
(填增大、减小或不变)
。
0.2mol/LHCl 溶液中由水电离出的 c(H+)。(填
B 反应①、②同时降温
(填相同或不同)
(2)常温下,若将 pH=3 的 HR 溶液与 p H =11 的 NaOH 溶液等体积混合,测得溶液的 p H 不
等于 7,则该混合溶液的 p H
。(填“>7”、“<7”或“不能确定”)
化学与生活(选修模块)(共 24 分)
21.(8 分)自来水厂需对原水经过除去固体杂质和悬浮物、消毒、除去异味等一系列净化
程序后才能使其成为生活、生产用水。
(1) 说明在该过程中假如下列物质的化学式、目的及所利用的原理。
明 矾 : 化 学 式 为
的
原理
臭 氧 : 化 学 式 为
的
原理
,
,
, 目
;
, 目
;
22.(8 分)炒过菜的铁锅未及时洗净(残液中含 NaCl),第二天便会因腐蚀出现红褐色锈
斑。试回答:
(1) 铁 锅 的 腐 蚀 主 要 是 由 于
腐 蚀 , 腐 蚀 的 原 因
是
,
(2) 铁锅锈蚀的正极反应式为
;
�
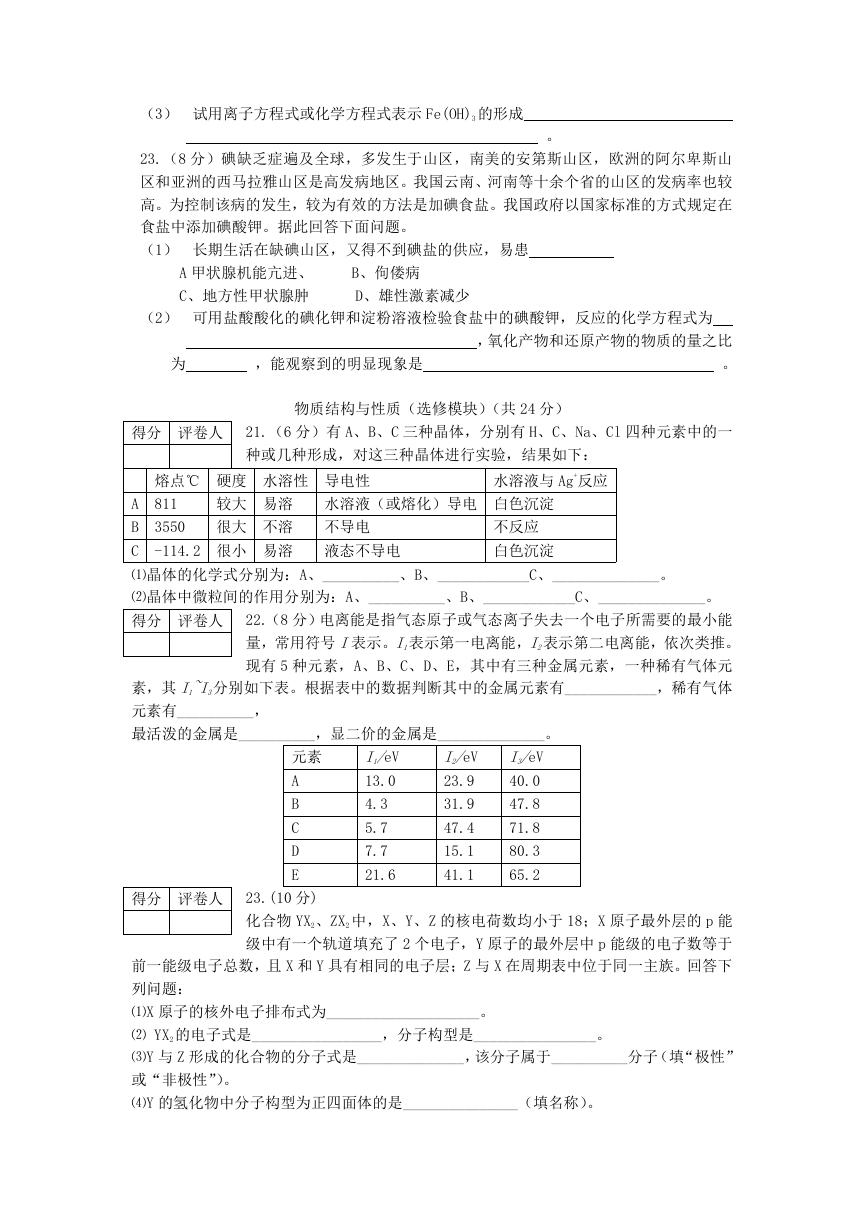
(3) 试用离子方程式或化学方程式表示 Fe(OH)3 的形成
。
23.(8 分)碘缺乏症遍及全球,多发生于山区,南美的安第斯山区,欧洲的阿尔卑斯山
区和亚洲的西马拉雅山区是高发病地区。我国云南、河南等十余个省的山区的发病率也较
高。为控制该病的发生,较为有效的方法是加碘食盐。我国政府以国家标准的方式规定在
食盐中添加碘酸钾。据此回答下面问题。
(1) 长期生活在缺碘山区,又得不到碘盐的供应,易患
A 甲状腺机能亢进、
C、地方性甲状腺肿
B、佝偻病
D、雄性激素减少
(2) 可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾,反应的化学方程式为
为
,能观察到的明显现象是
,氧化产物和还原产物的物质的量之比
。
物质结构与性质(选修模块)(共 24 分)
得分 评卷人
21.(6 分)有 A、B、C 三种晶体,分别有 H、C、Na、Cl 四种元素中的一
种或几种形成,对这三种晶体进行实验,结果如下:
熔点℃ 硬度 水溶性 导电性
水溶液与 Ag+反应
较大 易溶
水溶液(或熔化)导电 白色沉淀
811
3550
A
B
C
很大 不溶
不导电
-114.2 很小 易溶
液态不导电
不反应
白色沉淀
⑴晶体的化学式分别为:A、__________、B、____________C、______________。
⑵晶体中微粒间的作用分别为:A、__________、B、____________C、______________。
得分 评卷人
22.(8 分)电离能是指气态原子或气态离子失去一个电子所需要的最小能
量,常用符号 I表示。I1表示第一电离能,I2表示第二电离能,依次类推。
现有 5 种元素,A、B、C、D、E,其中有三种金属元素,一种稀有气体元
素,其 I1~I3分别如下表。根据表中的数据判断其中的金属元素有____________,稀有气体
元素有__________,
最活泼的金属是__________,显二价的金属是______________。
元素
A
B
C
D
E
I1/eV
13.0
4.3
5.7
7.7
21.6
I2/eV
23.9
31.9
47.4
15.1
41.1
I3/eV
40.0
47.8
71.8
80.3
65.2
得分 评卷人
23.(10 分)
化合物 YX2、ZX2 中,X、Y、Z 的核电荷数均小于 18;X 原子最外层的 p 能
级中有一个轨道填充了 2 个电子,Y 原子的最外层中 p 能级的电子数等于
前一能级电子总数,且 X 和 Y 具有相同的电子层;Z 与 X 在周期表中位于同一主族。回答下
列问题:
⑴X 原子的核外电子排布式为____________________。
⑵ YX2 的电子式是_________________,分子构型是________________。
⑶Y 与 Z 形成的化合物的分子式是______________,该分子属于__________分子(填“极性”
或“非极性”)。
⑷Y 的氢化物中分子构型为正四面体的是_______________(填名称)。
�
参考答案
�
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc