2020 北京市中考化学真题及答案
考生须知
1.本试卷共 6 页,共两部分,24 道小题,满分 45 分。考试时间:与生物合计 90 分钟。
2.在试卷和草稿纸上准确填写姓名、准考证号、考场号和座位号。
3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
4.在答题卡上,选择题、画图题用 2B 铅笔作答,其他试题用黑色字迹签字笔作答。
5.考试结束,将本试卷、答题卡和草稿纸一并交回。
可能用到的相对原子质量: H 1 C 12 O 16 S 32 Na 23 Cl 35.5
第一部分(选择题 共 12 分)
每小题 1 份。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.为了防止骨质疏松,人体需要摄入的元素是( )
A. 钙
B. 铁
C. 锌
D. 碘
2.下列气体能供给动植物呼吸的是( )
A.
2CO
B
2H
C
2O
D
2N
3.下列含金属元素的物质是( )
A.
SH2
B.
2OP
5
C.
AgNO
3
D.
OH2
4.下列不属于...铁丝在氧气中燃烧现象的是( )
A. 放出热量
C. 火星四溅
B. 产生大量白烟
D. 生成黑色固体
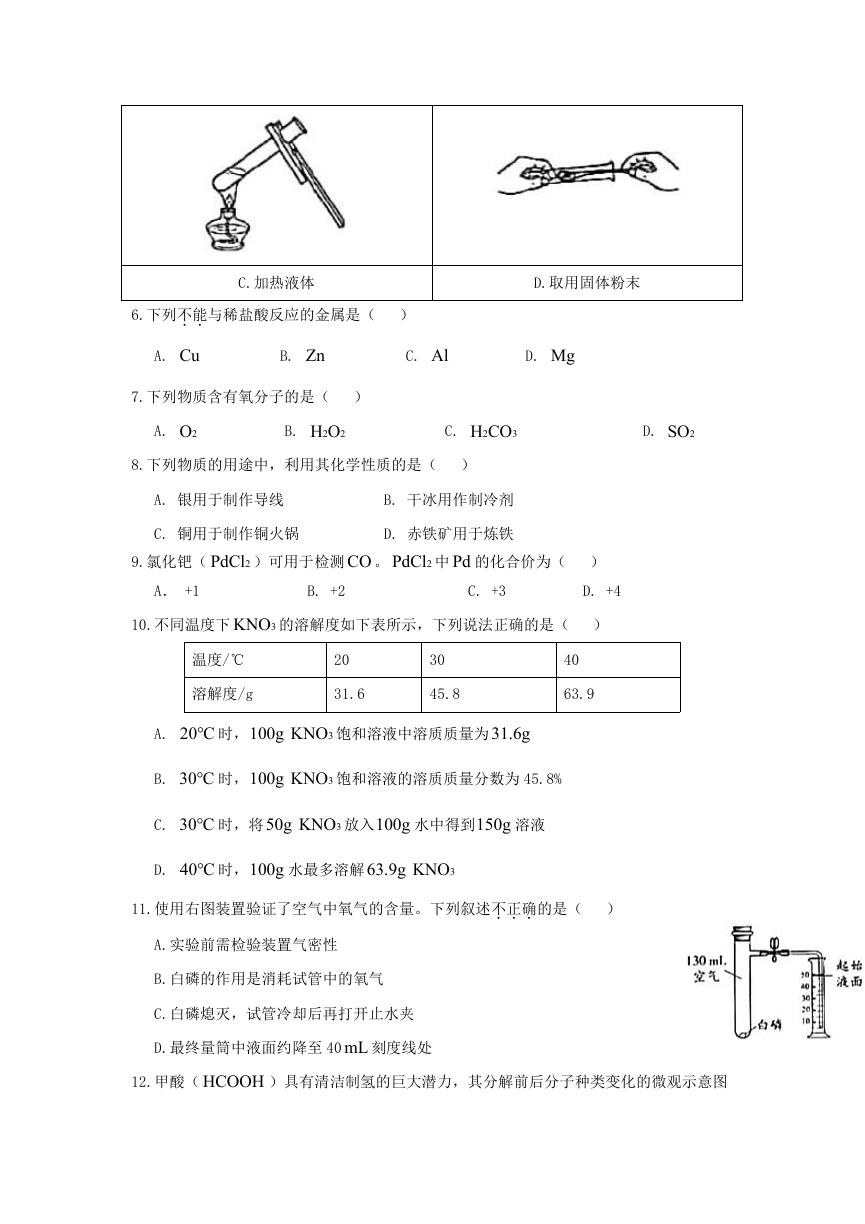
5.下列操作不正确的是( )
A.稀释浓硫酸
B.点燃酒精灯
�
C.加热液体
D.取用固体粉末
6.下列不能..与稀盐酸反应的金属是( )
A. Cu
B. Zn
C.
Al
D. Mg
7.下列物质含有氧分子的是( )
A.
2O
B.
OH 2
2
C.
2COH
3
D.
2SO
8.下列物质的用途中,利用其化学性质的是( )
A. 银用于制作导线
B. 干冰用作制冷剂
C. 铜用于制作铜火锅
PdCl )可用于检测 CO 。
2
9.氯化钯(
A. +1
D. 赤铁矿用于炼铁
PdCl 中 Pd 的化合价为( )
2
B. +2
C. +3
D. +4
10.不同温度下
KNO 的溶解度如下表所示,下列说法正确的是( )
3
温度/℃
溶解度/g
20
31.6
30
45.8
40
63.9
A. ℃20 时,100g
KNO 饱和溶液中溶质质量为31.6g
3
B. ℃30 时,100g
KNO 饱和溶液的溶质质量分数为 45.8%
3
C. ℃30 时,将50g
KNO 放入100g 水中得到150g 溶液
3
D. ℃40 时,100g 水最多溶解 63.9g
KNO
3
11.使用右图装置验证了空气中氧气的含量。下列叙述不正确...的是( )
A.实验前需检验装置气密性
B.白磷的作用是消耗试管中的氧气
C.白磷熄灭,试管冷却后再打开止水夹
D.最终量筒中液面约降至 40 mL 刻度线处
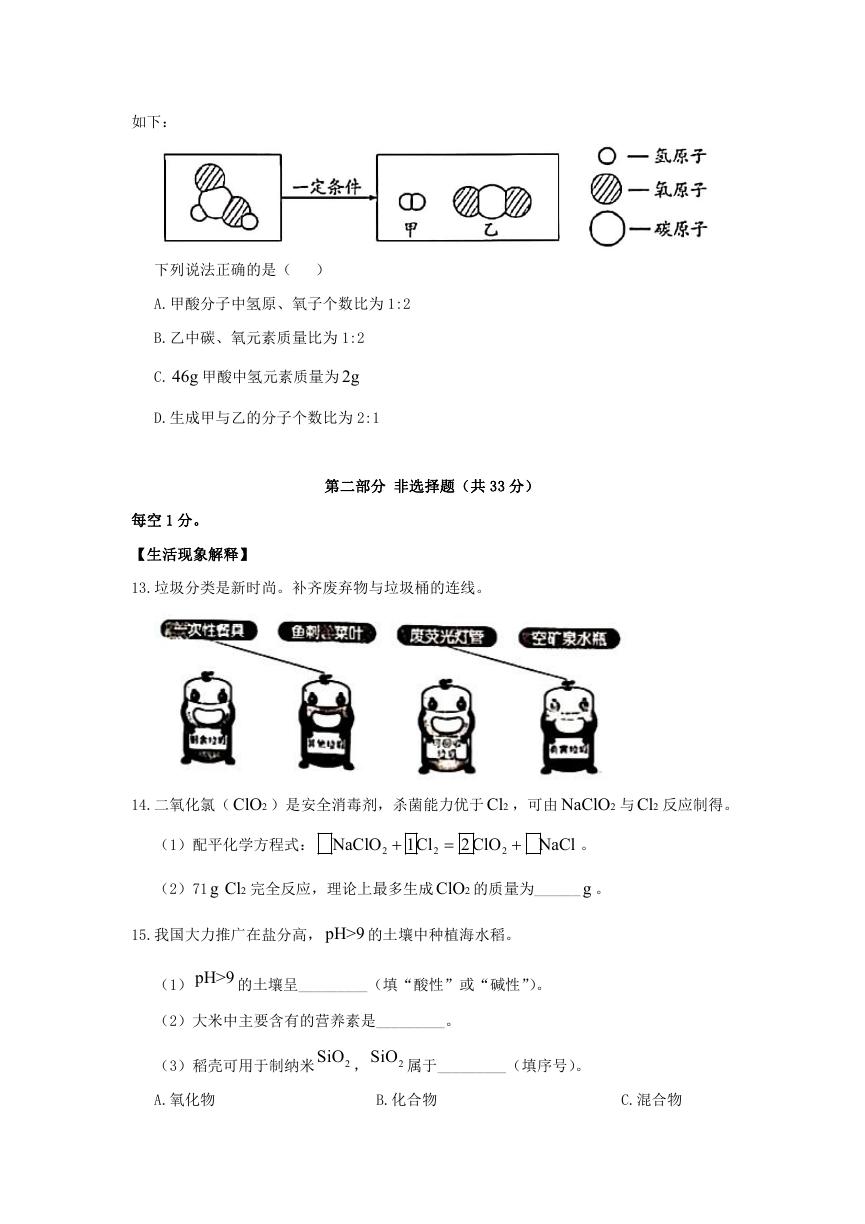
12.甲酸( HCOOH )具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图
�
如下:
下列说法正确的是( )
A.甲酸分子中氢原、氧子个数比为 1:2
B.乙中碳、氧元素质量比为 1:2
C.
g46 甲酸中氢元素质量为 g2
D.生成甲与乙的分子个数比为 2:1
第二部分 非选择题(共 33 分)
每空 1 分。
【生活现象解释】
13.垃圾分类是新时尚。补齐废弃物与垃圾桶的连线。
14.二氧化氯(
2ClO )是安全消毒剂,杀菌能力优于 2Cl ,可由
NaClO 与 2Cl 反应制得。
2
(1)配平化学方程式:
NaClO 1Cl
2
2 ClO
2
2
NaCl
。
(2)71 g
2Cl 完全反应,理论上最多生成
2ClO 的质量为______ g 。
15.我国大力推广在盐分高, pH>9 的土壤中种植海水稻。
(1) pH>9 的土壤呈_________(填“酸性”或“碱性”)。
(2)大米中主要含有的营养素是_________。
(3)稻壳可用于制纳米 2SiO , 2SiO 属于_________(填序号)。
A.氧化物
B.化合物
C.混合物
�
【科普阅读题理解】
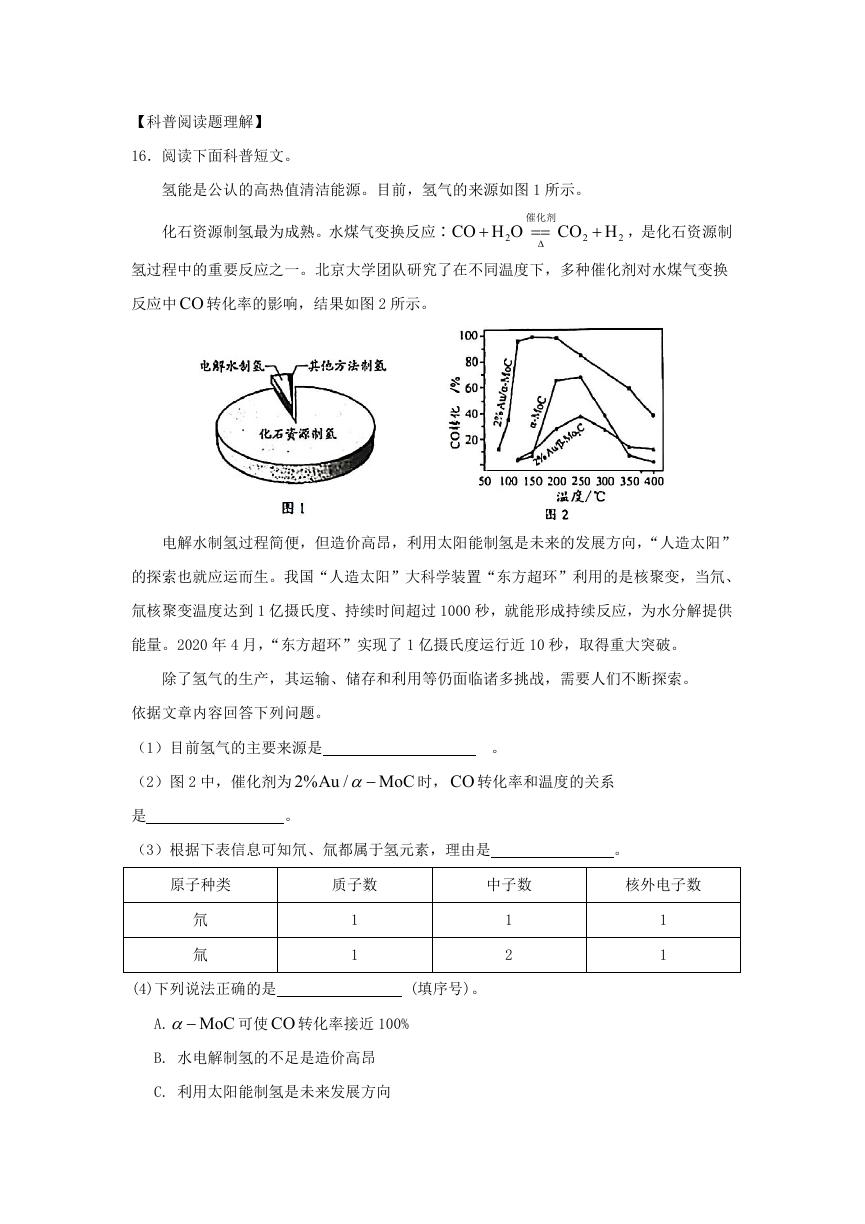
16.阅读下面科普短文。
氢能是公认的高热值清洁能源。目前,氢气的来源如图 1 所示。
化石资源制氢最为成熟。水煤气变换反应∶
CO H O
2
催化剂
CO H
2
,是化石资源制
2
氢过程中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换
反应中 CO 转化率的影响,结果如图 2 所示。
电解水制氢过程简便,但造价高昂,利用太阳能制氢是未来的发展方向,“人造太阳”
的探索也就应运而生。我国“人造太阳”大科学装置“东方超环”利用的是核聚变,当氘、
氚核聚变温度达到 1 亿摄氏度、持续时间超过 1000 秒,就能形成持续反应,为水分解提供
能量。2020 年 4 月,“东方超环”实现了 1 亿摄氏度运行近 10 秒,取得重大突破。
除了氢气的生产,其运输、储存和利用等仍面临诸多挑战,需要人们不断探索。
依据文章内容回答下列问题。
(1)目前氢气的主要来源是
。
(2)图 2 中,催化剂为 2%Au / MoC
时, CO 转化率和温度的关系
是
。
(3)根据下表信息可知氘、氚都属于氢元素,理由是
。
原子种类
质子数
中子数
核外电子数
氘
氚
1
1
1
2
1
1
(4)下列说法正确的是
(填序号)。
A. MoC
可使 CO 转化率接近 100%
B. 水电解制氢的不足是造价高昂
C. 利用太阳能制氢是未来发展方向
�
D. “东方超环”利用核聚变提供能量
【生产实际分析】
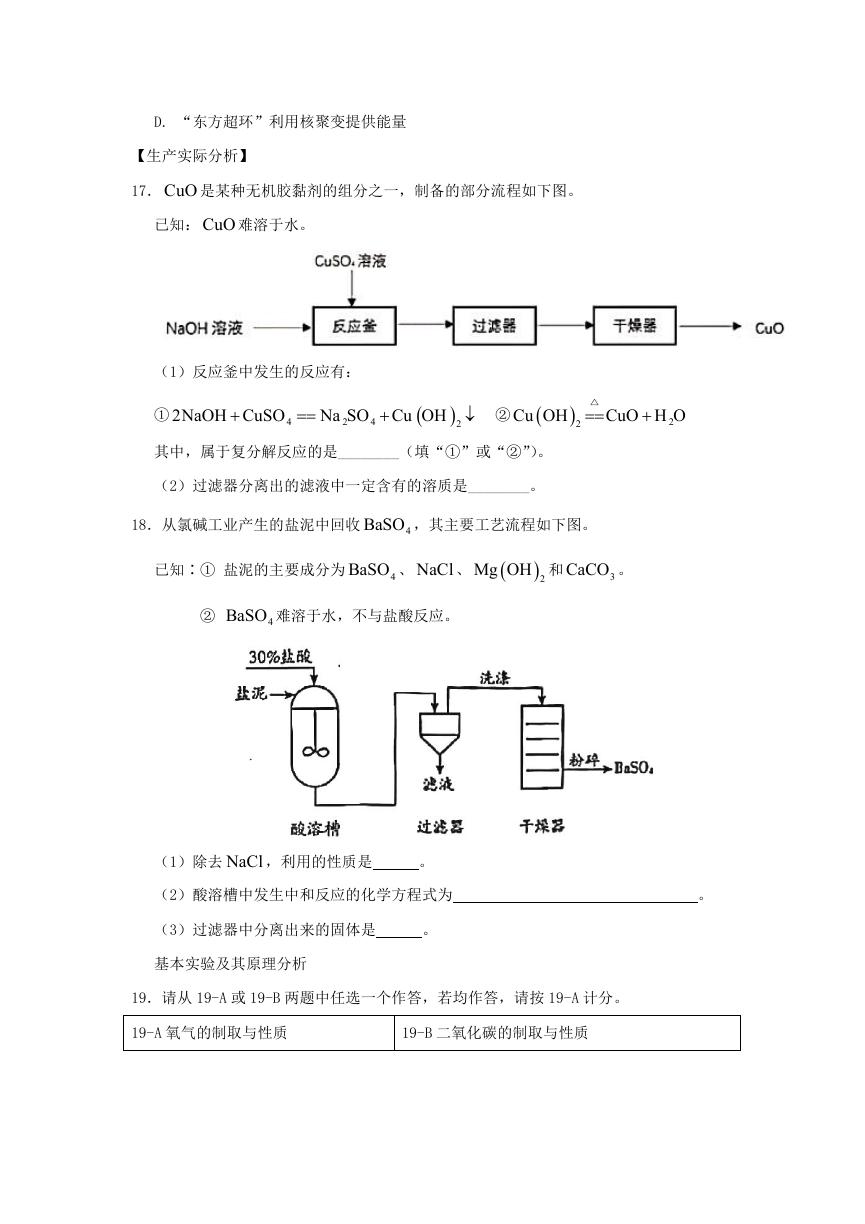
17. CuO 是某种无机胶黏剂的组分之一,制备的部分流程如下图。
已知: CuO 难溶于水。
(1)反应釜中发生的反应有:
①
2NaOH CuSO
4
Na SO Cu OH
2
4
2
②
Cu OH
△
2
CuO H O
2
其中,属于复分解反应的是________(填“①”或“②”)。
(2)过滤器分离出的滤液中一定含有的溶质是________。
18.从氯碱工业产生的盐泥中回收
BaSO ,其主要工艺流程如下图。
4
已知∶① 盐泥的主要成分为
BaSO 、 NaCl 、
Mg OH 和
4
2
CaCO 。
3
②
BaSO 难溶于水,不与盐酸反应。
4
(1)除去 NaCl ,利用的性质是
。
(2)酸溶槽中发生中和反应的化学方程式为
。
(3)过滤器中分离出来的固体是
。
基本实验及其原理分析
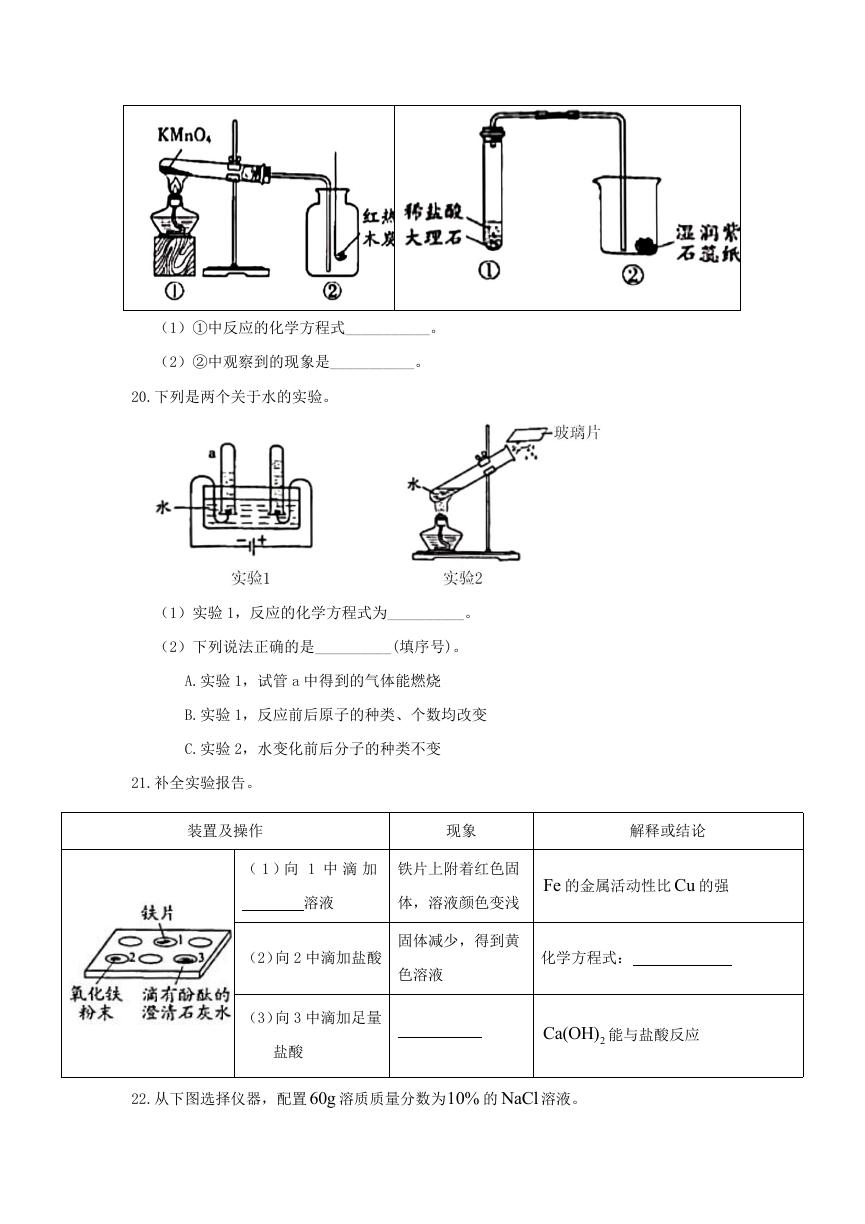
19.请从 19-A 或 19-B 两题中任选一个作答,若均作答,请按 19-A 计分。
19-A 氧气的制取与性质
19-B 二氧化碳的制取与性质
�
(1)①中反应的化学方程式___________。
(2)②中观察到的现象是___________。
20.下列是两个关于水的实验。
(1)实验 1,反应的化学方程式为__________。
(2)下列说法正确的是__________(填序号)。
A.实验 1,试管 a 中得到的气体能燃烧
B.实验 1,反应前后原子的种类、个数均改变
C.实验 2,水变化前后分子的种类不变
21.补全实验报告。
装置及操作
现象
解释或结论
( 1 )向 1 中 滴 加
铁片上附着红色固
溶液
体,溶液颜色变浅
Fe 的金属活动性比 Cu 的强
(2)向 2 中滴加盐酸
化学方程式:
固体减少,得到黄
色溶液
(3)向 3 中滴加足量
盐酸
Ca(OH) 能与盐酸反应
2
22.从下图选择仪器,配置 60g 溶质质量分数为10% 的 NaCl 溶液。
�
(1)需要称量 NaCl 的质量为
g
(2)量取水用到的仪器有
(写名称)。
(3)从配好的溶液中倒出10g ,其中溶质和溶剂的质量比为
。
23. 验证可燃物燃烧的条件。已知:白磷、红磷的着火点分别是 40℃、240℃。
装置(夹持仪器己略去)
步骤及现象
Ⅰ.将一定量的白磷、红磷分别浸入 80℃热水中(如
左图所示)。白磷、红磷均不燃烧
Ⅱ.升高右侧漏斗至红磷露出水面。红磷不燃烧
Ⅲ.升高左侧漏斗至白磷露出水面。白磷燃烧
(1)Ⅰ中白磷不燃烧的原因是
。
( 2 ) 对 比 Ⅱ 和 Ⅲ , 可 验 证 可 燃 物 燃 烧 的 条 件 是
。
〖科学探究〗
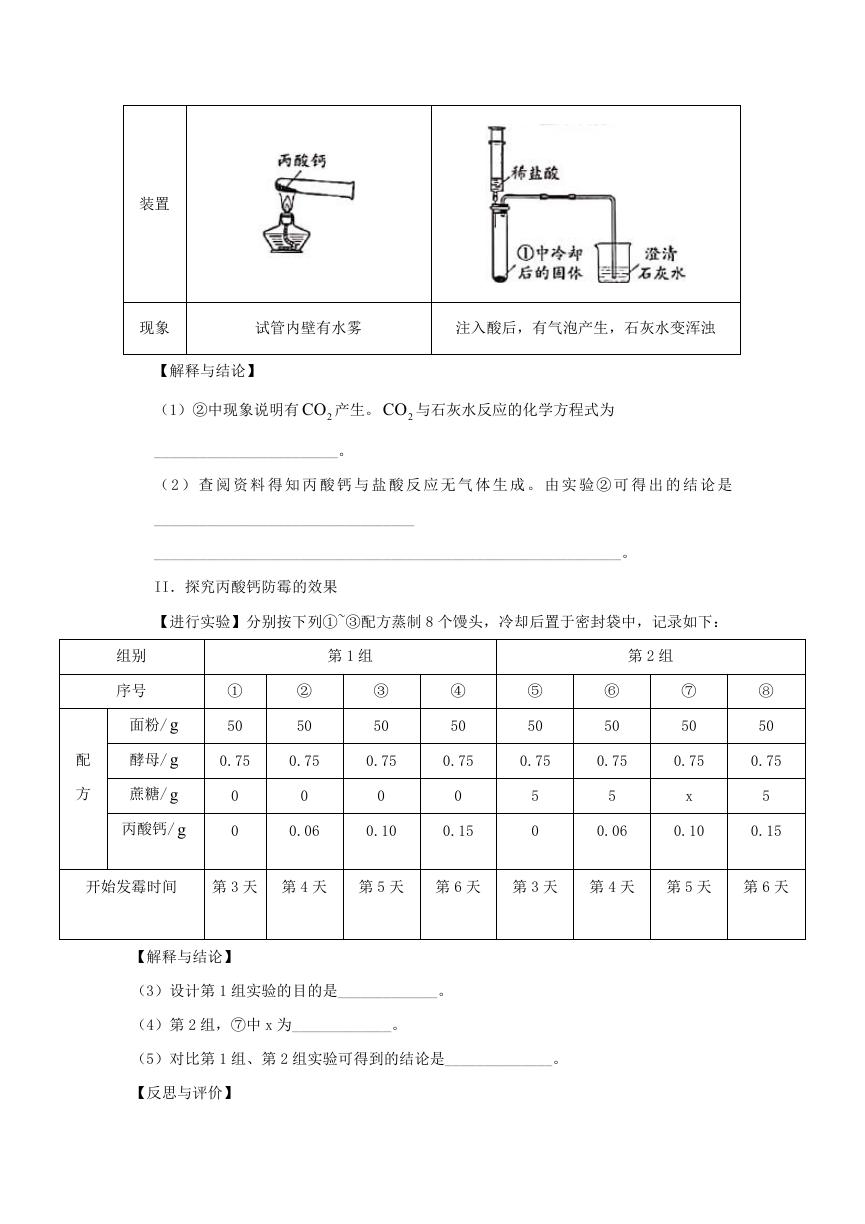
24.丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、
糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
序号
1
2
�
装置
现象
试管内壁有水雾
注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有 2CO 产生。 2CO 与石灰水反应的化学方程式为
________________________。
( 2 ) 查 阅 资 料 得 知 丙 酸 钙 与 盐 酸 反 应 无 气 体 生 成 。 由 实 验 ② 可 得 出 的 结 论 是
__________________________________
_____________________________________________________________。
II.探究丙酸钙防霉的效果
【进行实验】分别按下列①~③配方蒸制 8 个馒头,冷却后置于密封袋中,记录如下:
组别
序号
面粉/ g
酵母/ g
蔗糖/ g
丙酸钙/ g
配
方
第 1 组
第 2 组
①
50
②
50
③
50
④
50
⑤
50
⑥
50
⑦
50
⑧
50
0.75
0.75
0.75
0.75
0.75
0.75
0.75
0.75
0
0
0
0
0
0.06
0.10
0.15
5
0
5
x
5
0.06
0.10
0.15
开始发霉时间
第 3 天 第 4 天
第 5 天
第 6 天
第 3 天
第 4 天
第 5 天
第 6 天
【解释与结论】
(3)设计第 1 组实验的目的是_____________。
(4)第 2 组,⑦中 x 为_____________。
(5)对比第 1 组、第 2 组实验可得到的结论是______________。
【反思与评价】
�










 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc