2002 年上海高考化学真题及答案
本试卷分为第Ⅰ卷(第 1~4 页)和第Ⅱ卷(第 5~10 页)两部分。全卷共 10 页。满分
150 分。考试时间 120 分钟。
第 I 卷(共 66 分)
考生注意:
1.答第Ⅰ卷前。考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号、校验
码,并用铅笔正确涂写准考证号和校验码。
2.第Ⅰ卷(1~22 题),由机器阅卷,答案必须全部涂写在答题纸上。考生应将代表正
确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号—一对应,不能错位。答案需要更
改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
C-12
可能用到的相对原子质量:
H-1
一、选择题(本题共 10 分),每小题 2 分,只有一个正确选项,答案涂写在答题纸上。
C
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
Cl-35.5
Ca-40
Cu-64
K-39
S-32
N-14
O-16
A. Mg2+
B. Ca2+
C. Na+
D. Fe3+
2.C60 与现代足球
有很相似的结构,它与石墨互为
A 同位素
B 同素异形体
C 同分异构体
D 同系物
3.下列表达方式错误的是
A 甲烷的电子式
B. 氟化钠的电子式
C. 硫离子的核外电子排布式 1s22s22p63s23p4
D. 碳-12 原子 6
12 C
B
C
4.将饱和 FeCl3 溶液分别滴入下述液体中,能形成胶体的是
B
B. 沸水
C. NaOH 浓溶液
A. 冷水
5.两次获得诺贝尔奖,在化学界享有盛名的科学家是
A. 爱因斯坦
C. 居里夫人
二、选择题(本题共 36 分),每小题 3 分,只有一个正确选项,答案涂写在答题纸上。
6.有人认为在元素周期表中,位于ⅠA 族的氢元素,也可以放在ⅦA 族,下列物质能支
C
D. NaCl 浓溶液
C
B. 达尔文
D. 欧拉
持这种观点的是
A. HF
D. H2O2
解析:NaH 与 NaCl 都是离子化合物,H 与 Cl 相似。
C. NaH
B. H3O+
�
C
B. 原子晶体中,只存在共价键
D. 稀有气体的原子能形成分子晶体
7.在下列有关晶体的叙述中错误的是
A. 离子晶体中,一定存在离子键
C. 金属晶体的熔沸点均很高
解析:金属晶体的熔沸点可能比较高,如金属钨的熔点可达 3410℃;而金属汞的熔点
非常低,常温下呈液态,故 C 项的说法是错误的。对于稀有气体是单原子分子,它们可按范
德华力结合成分子晶体,因此 D 项是正确的。
8.NA 为阿佛加德罗常数,下述正确的是
A. 80 g 硝酸铵含有氮原子数为 2NA
B. 1 L 1 mol / L 的盐酸溶液中,所含氯化氢分子数为 NA
C. 标准状况下,11.2 L 四氯化碳所含分子数为 0.5 NA
D. 在铜与硫的反应中,1 mol 铜失去的电子数为 2 NA
9.在 pH=1 的无色溶液中能大量共存的离子组是
A
A
A. NH4
+ 、Mg2+、 2
4SO 、Cl-
B. Ba2+、K+、OH-、
3NO
C. Al3+、Cu2+、 2
4SO 、Cl-
D. Na+、Ca2+、Cl-、
2AlO
10.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到 165K 时形
成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻
璃态水的叙述正确的是
C
A. 水由液态变为玻璃态,体积缩小
C. 玻璃态是水的一种特殊状态
解析:玻璃态水的的密度与普通液态水的密度相同,因此体积不会减小,也不会膨胀。
B. 水由液态变为玻璃态,体积膨胀
D. 玻璃态水是分子晶体
玻璃态的水无固定形状,不存在晶体结构,也不会是晶体。故只有 C 的叙述是正确的。
11.已知自然界氧的同位素有 16O、17O、18O,氢的同位素有 H、D,从水分子的原子组成
来看,自然界的水一共有
C
A. 3 种
12.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都
B. 6 种
C. 9 种
D. 12 种
特别好的氟橡胶。它的结构简式见右图:
合成它的单体为
B
A. 氟乙烯和全氟异丙烯
C. 1-三氟甲基-1,3-丁二烯
13.以下实验能获得成功的是
B. 1,1-二氟乙烯和全氟丙烯
D. 全氟异戊二烯
D
A. 用含结晶水的醋酸钠和碱石灰共热制甲烷气体
B. 将铁屑、溴水、苯混合制溴苯
C. 在苯酚溶液中滴入少量稀溴水出现白色沉淀
D. 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
14.拟除虫菊酯是一类高效、低毒、对昆虫
具有强烈触杀作用的杀虫剂,其中对光稳定的溴
氰菊酯的结构简式如右图:
�
下列对该化合物叙述正确的是
D
B. 属于卤代烃
D. 在一定条件下可以发生加成反应
A. 属于芳香烃
C. 在酸性条件下不水解
解析:只含有 C、H 且带有苯环的有机物是芳香烃,卤代烃分子里只含有 C、H 和卤素原
子,而所给的物质还含有 N 和 O 原子,所以它既不是芳香烃,也不是卤代烃。该分子里含有
酯基,可以在碱性或酸性条件下水解,分子里含有碳碳双键,是可以发生加成反应的。故正
确的是 D。
15.将足量 CO2 通人 KOH 和 CaOH2 的混合稀溶液中,生成沉淀的物质的量(n)和通入
CO2 体积(y)的关系正确的是
D
A
B
C
D
16.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电
解饱和氯化钠溶液,通电时,为使 Cl2 被完全吸收,制得有较强杀菌能力
的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分
判断正确的是
B
A. a 为正极,b 为负极;NaClO 和 NaCl
B. a 为负极,b 为正极;NaClO 和 NaCl
C. a 为阳极,b 为阴极;HClO 和 NaCl
D. a 为阴极,b 为阳极;HClO 和 NaCl
解析:用石墨做电极电解饱和食盐水发生的反应是:2NaCl+2H2O
2NaOH+ H2
↑+Cl2↑。伴随电解过程所发生的副反应是 Cl2+2NaOH=NaCl+NaClO+H2O,则可推知使
Cl2 被完全吸收制得有较强杀菌能力的消毒液主要成分是 NaClO 和 NaCl,起消毒作用的是
NaClO。电解过程阴极产生氢气,结合图示,,消毒液发生器的液体上部空间充满的是氢气,
从中推知电源 a 极是负极,b 极为正极。
17.1998 年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域
作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化
学领域正在经历一场革命性的变化。下列说法正确的是
A
A. 化学不再是纯实验科学
C. 化学不做实验,就什么都不知道
三、选择题(本题共 20 分),每小题 4 分,每小题有一个或两个正确选项。只有一个正
确选项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个该小题不给分,答
案涂写在答题纸上。
B. 化学不再需要实验
D. 未来化学的方向还是经验化
18.在相同温度时 100 mL 0.01 mol / L 的醋酸溶液与 10 mL 0.01 mol / L 的醋酸溶
液 相 比 较 , 下 列 数 值 前 者 大 于 后 者 的 是
BC
A. 中和时所需 NaOH 的量
B. 电离度
�
C. 对的物质的量
19.下列离子方程式书写正确的是
A. FeCl2 溶液中通入 Cl2:Fe2++Cl2→Fe3++2Cl-
D. CH3COOH 的物质的量
B
B. 澄清石灰水与少量小苏打溶液混合:Ca2+十 OH-+
HCO →CaCO3↓+H2O
3
C. FeS 固体放入稀硝酸溶液中:FeS+2H+→Fe2++H2S↑
D. AlCl3 溶液中加入过量氨水:Al3++4OH-→
2AlO +2H2O
解析:A 违背了离子电荷守恒,B;C 违背了客观性原理,稀硝酸将氧化 FeS,不可能生
成氢气。D 既违背了书写规则,又违背了客观性原理,氨水应写 NH3·H2O,生成的 AlOH3
+
不会溶解于氨水中:Al3++3NH3·H2O=AlOH3+3NH4
20.在常温下 10 mL pH=10 的 KOH 溶液中,加人 pH=4 的一元酸 HA 溶液至 pH 刚好等
于 7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
AD
A. cA-=cK+
C. V总≥20 mL
21.混合下列各组物质使之充分反应,加热蒸干产物并在 300℃灼烧至质量不变,最终
BD
B. cH+=cOH-<cK+<cA-
D. V总≤20 mL
残留固体为纯净物的是
A. 向 CuSO4 溶液中加入适量铁粉
B. 等物质的量浓度、等体积的NH42SO4 与 BaCl2 溶液
C. 等物质的量的 NaHCO3 与 Na2O2 固体
D. 在 NaBr 溶液中通入过量氯气
22.0.03 mol 铜完全溶于硝酸,产生氮的氧化物 NO、NO2、N2O4 混合气体共 0.05 mol。
BC
该混合气体的平均相对分子质量可能是
C. 50
A. 30
B. 46
D. 66
第Ⅱ卷(共 84 分)
考生注意:
1.答第Ⅱ卷前,考生务必将姓名、准考证号、校验码等填写清楚。
2.第Ⅱ卷从第 23 题到第 31 题,考生应用钢笔或圆珠笔将答案直接写在试卷上。
四、(本题共 24 分)
23.在氯氧化法处理含 CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸
盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含 KCN,其浓度为 650 mg / L。现用氯氧化法处理,发生如下反应(其
中 N 均为-3 价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 __________
。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出
电子转移方向和数目:
KOCN+ KOH+ Cl2 →
H2O
(3)若处理上述废水 20 L,使 KCN 完全转化为无毒物质,至少需液氯
23.(1)碳或(C)
KCl +
CO2 +
N2 +
g。
�
(3) 35.5
24.在一定体积的密闭容器中,进行如下化学反应:CO2g+H2g
COg+H2O(g),
其化学平衡常数 K和温度 t的关系如下表:
t℃
K
700
0.6
800
0.9
830
1.0
1000
1.7
1200
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为 K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变
(c)正H2=逆H2O
(4)某温度下,平衡浓度符合下式:cCO2·cH2=cCO·cH2O,试判断此时的温度
(b)混合气体中 cCO不变
反应(选填吸热、放热)。
(d)cCO2=cCO
(多选扣分)。
。
为
℃。
解析:1
c
c
)OH()CO(
c
)H()
CO(
c
2
2
2
(2)K随温度的升高而增大,说明正反应为“吸热”反应
(3)正逆反应速率相等,浓度保持不变是平衡状态,而容器中压强不变,及两物质浓度相
(4)由于 cCO2·cH2=cCO·cH2O,
等都不能判断是否为平衡状态,应选“b、c”
c
c
=1,查表知为“830”℃。
)OH()CO(
c
)H()
CO(
c
2
2
2
24.(1)
c
c
)OH()CO(
c
)H()
CO(
c
2
2
2
(2)吸热
(3)b、c
(4)830
25.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环
境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl 等作致冷剂,但它们不是有毒,
就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
>
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期
>H2O、HF;
第三周期 SiH4>PH3>
>
(2)化合物的毒性:PH3>NH3
CS2
于是科学家们开始把注意力集中在含 F、Cl 的化合物上。
(3)已知 CCl4 的沸点为 76.8℃,CF4 的沸点为-128℃,新致冷剂的沸点范围应介于其
间。经过较长时间反复试验,一种新的致冷剂氟里昂 CF2Cl2 终于诞生了,其它类似的还可以
是
H2O;
CF4 (选填>或<、=。
CO2 CCl4
H2S
。
。
(4)然而,这种致冷剂造成了当今的某一环境问题是
但求助于周期表中元素及其化合物的
变化趋势来开发致冷剂的科学思维方法是
。
值得借鉴的。(填写字母,多选扣分)
① 毒性 ② 沸点 ③ 易燃性 ④ 水溶性 ⑤ 颜色
(a)①②③
25.(1)CH4>NH3,H2S>HCl
(3) CFCl3(或 CF3Cl)
(c)②③④
(2) > ,>
(b)②④⑤
(4)使大气臭氧层出现空洞
五、(本题共 24 分)
�
26.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电
石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔
中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
(2)甲同学设计的实验
(多选扣分)。
是
(填能或不能)验证乙炔与澳发生加成反应,其理由
。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是
,它与溴水反应的化学
方程式是
;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号
填入方框,并写出装置内所放的化学药品。
(a)
→ b →
(b)
→ d
(c)
(d)
(电石、水)(
(5)为验证这一反应是加成而不是取代,丙同学提出可用 pH 试纸来测试反应后溶液的
) (溴水)
) (
酸性,理由是
。
解析:电石中含有杂质硫化物,在与水反应时会产生硫化氢气体。由于 H2S 具有还原性,
将与溴水中的 Br2 发生反应,从而使溴水褪色,并析出硫黄。
26 1 CaC2+2H2O C2H2+CaOH2
+
Br2+H2S→S↓+2HBr
(2)不能 a、c
(3)H2S
(4) c
(CuSO4 溶液)(CuSO4 溶液)
(5)如若发生取代反应,必定生成 HBr,溶液酸性将会明显增强,故可用 pH 试纸验证。
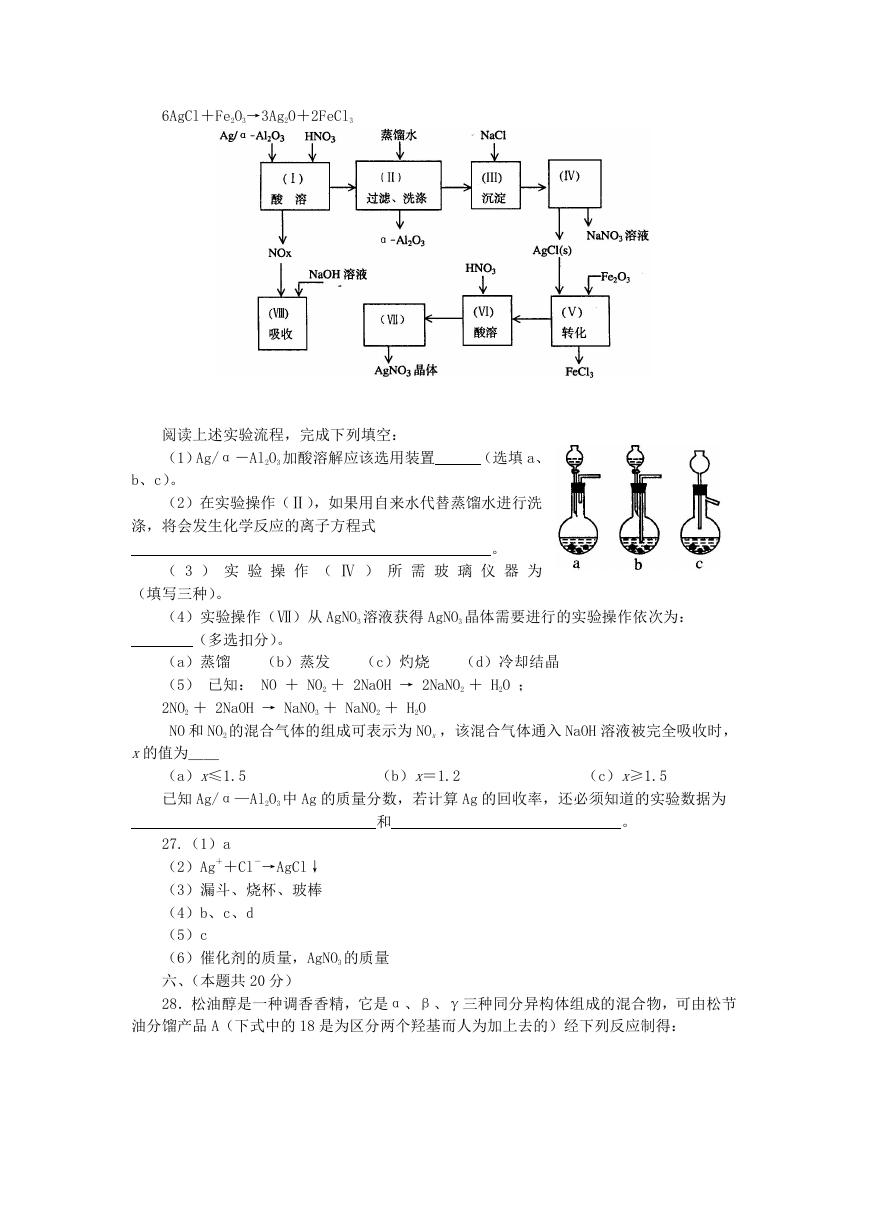
27.Ag/α-Al2O3 是石油化学工业的一种重要催化剂,其中 Ag 起催化作用,α-Al2O3
b
是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:
�
6AgCl+Fe2O3→3Ag2O+2FeCl3
阅读上述实验流程,完成下列填空:
(1)Ag/α-Al2O3 加酸溶解应该选用装置
(选填 a、
b、c)。
(2)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗
涤,将会发生化学反应的离子方程式
( 3 ) 实 验 操 作 ( Ⅳ ) 所 需 玻 璃 仪 器 为
(填写三种)。
。
(4)实验操作(Ⅶ)从 AgNO3 溶液获得 AgNO3 晶体需要进行的实验操作依次为:
(多选扣分)。
(b)蒸发
(c)灼烧
(a)蒸馏
(5) 已知: NO + NO2 + 2NaOH → 2NaNO2 + H2O ;
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
NO 和 NO2 的混合气体的组成可表示为 NOx ,该混合气体通入 NaOH 溶液被完全吸收时,
(d)冷却结晶
x的值为__
(a)x≤1.5
已知 Ag/α—Al2O3 中 Ag 的质量分数,若计算 Ag 的回收率,还必须知道的实验数据为
(b)x=1.2
(c)x≥1.5
和
。
27.(1)a
(2)Ag++Cl-→AgCl↓
(3)漏斗、烧杯、玻棒
(4)b、c、d
(5)c
(6)催化剂的质量,AgNO3 的质量
六、(本题共 20 分)
28.松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节
油分馏产品 A(下式中的 18 是为区分两个羟基而人为加上去的)经下列反应制得:
�
试回答:
(1)α—松油醇的分子式
(2)α—松油醇所属的有机物类别是
(a)醇
(3)α—松油醇能发生的反应类型是
(a)加成
(4)在许多香料中松油醇还有少量的以脂的形式出现,写出 RCOOH 和α—松油醇反应
(c)饱和一元醇
(多选扣分)
(b)酚
(b)水解
(c)氧化
(多选扣分)
的化学方程式
。
(5)写结简式:β—松油醇
解析:从α—松油醇分子的结构简式可知,它没有苯环,只有一个带碳碳双键的六元环,
,γ—松油醇
环上所连的碳原子上有一个羟基,故它不是酚类和饱和的一元醇,而是一种不饱和的醇。它
具有碳碳双键的性质,可以加成和氧化;也具有醇羟基的性质,可以发生酯化反应和消去反
应;但由于它是叔醇,较难发生氧化。因此,α—松油醇不能发生水解反应。
18O
28.(1)C10H18
(2)a
(3)a、c
29.某有机物 J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相
容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知:
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc