2020 山东省枣庄市中考化学真题及答案
1.能源和环境是人类生存的基本条件,下列叙述正确的是
A.煤、石油和天然气都属于可再生能源
B.电池在生产生活中应用广泛
C.就地焚烧废弃塑料,减少“白色污染”
D.禁止使用化石燃料,防止形成酸雨
2 预防新型冠状病毒肺炎,常用 84 消毒液对环境进行消杀。常温下测得某 84 消毒液显碱性,
其 pH 可能为
A.12
B.5
C.7
D.2
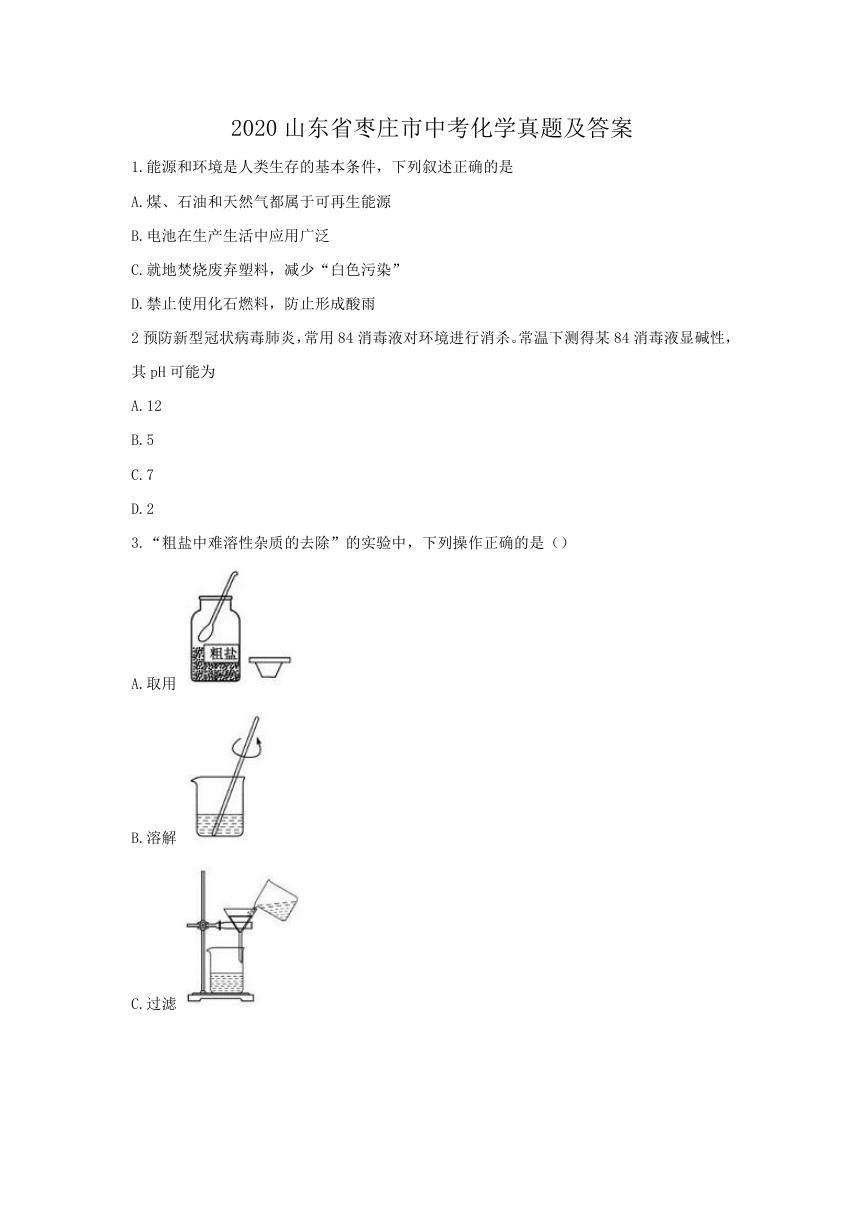
3.“粗盐中难溶性杂质的去除”的实验中,下列操作正确的是()
A.取用
B.溶解
C.过滤
�
D.蒸发
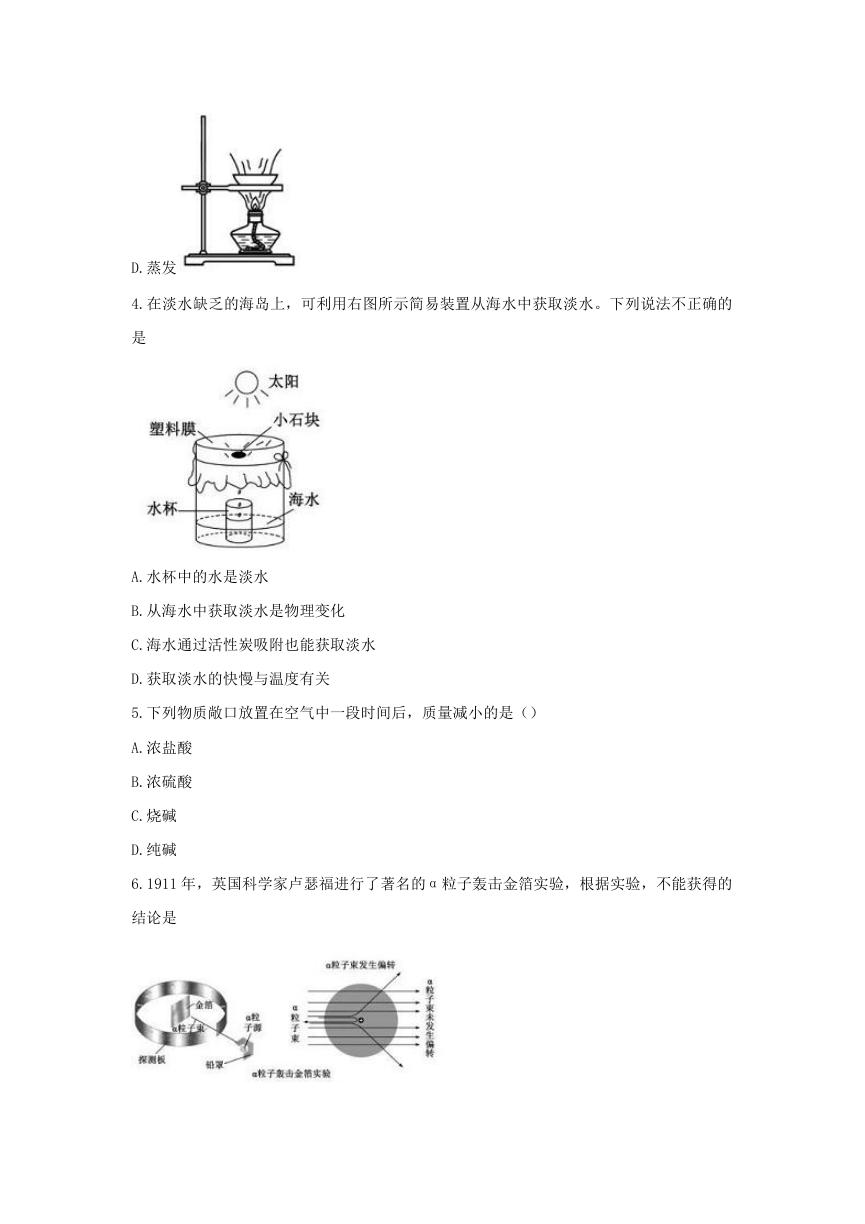
4.在淡水缺乏的海岛上,可利用右图所示简易装置从海水中获取淡水。下列说法不正确的
是
A.水杯中的水是淡水
B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水
D.获取淡水的快慢与温度有关
5.下列物质敞口放置在空气中一段时间后,质量减小的是()
A.浓盐酸
B.浓硫酸
C.烧碱
D.纯碱
6.1911 年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据实验,不能获得的
结论是
�
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比 a粒子大得多
7.将燃着的蜡烛放在图 1 所示的密闭容器中,同时用氧气传感器测出密闭容器中氧气含量
的变化如图 2 所示。下列说法不正确的是
A.蜡烛燃烧前,密闭容器中氧气的体积分数为 21%
B.蜡烛燃烧需要氧气
C.蜡烛熄灭后,密闭容器中还有氧气
D.蜡烛熄灭后,密闭容器中二氧化碳的体积分数为 84%
8.推理是学习化学的重要思维方法,下列推理中合理的是()
A.有机物一定含有碳元素,所以含有碳元素的物质一定是有机物
B.溶液是均一稳定的液体,所以均一稳定的液体都是溶液
C.碱性溶液能使酚酞试液变红色,所以能使酚酞试液变红色的溶液显碱性
D.中和反应一定能生成盐和水,所以生成盐和水的反应一定是中和反应
9.(5 分)人类文明进步与金属材料发展关系十分密切。回答下列问题。
(1)元素在自然界分布并不均匀,按质量计算,地壳中含量最多的金属元素是____________
(填符号)。
(2)钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理为
______________。
(3)《吕氏春秋》记载“金柔锡柔,合两柔则刚(即坚硬)”【注:金指铜单质,锡指锡单
质】。这句话说明铜锡合金具有的特性是________________(填字母)。
a.合金的熔点一般比其组分低
b.合金的硬度一般比其组分大
c.合金的抗腐蚀性一般比其组分强
(4)向硝酸银和硝酸锌的混合溶液中加入一定量的铜粉,观察到溶液由无色变为蓝色后,
�
对混合溶液进行过滤,则滤液中一定含有的溶质是___________________。
10.(4 分)a、b 两种固体物质的溶解度曲线如图所示,据图回答:
(1)两种物质中,溶解度随温度升高而减小的是_________________。
(2)当温度为______________℃时,a 和 b 的溶解度相等。
(3)t2°C 时,由图 2 推测 W 是图 1 中的_____________物质。
11.(6 分)“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”这
是明代民族英雄于谦的传世之作,蕴含着丰富的化学知识。诗中描绘的烧制熟石灰及其应
用过程如图所示:
(1)上图中石灰石、生石灰、熟石灰三种物质共同含有的元素为_______________(填符
号);
(2)上图中所涉及的物质中由离子构成的是________________(只填一种物质的化学式);
(3)虎门销烟时,林则徐把鸦片和生石灰共同投入水池销毁,简述其中的化学原理
________________。
(4)写出上图所示过程中④的化学方程式__________________________。
(5)碳酸钙在高温下分解为氧化钙和二氧化碳,其中各物质的质量关系可用下图表示:
则生成二氧化碳的质量占_________________%。
12.(5 分)如图为硫的价类图,纵坐标表示硫的化合价,横坐标表示含硫物质的类别,例
如:C 点可表示+4 价硫元素的氧化物(SO2)。请回答:
�
(1)A 点表示的物质中,阴离子的结构示意图为__________________。
(2)B 点表示的物质的类别是__________________。
(3)D 点表示的物质的化学式为__________________。
( 4 ) 若 F 点 表 示 的 物 质 为 含 三 种 元 素 的 钠 盐 , 写 出 由 E 到 F 的 化 学 方 程 式
__________________。
13.(9 分)蚊虫叮咬时能分泌出蚁酸刺激皮肤,某兴趣小组进行了如下探究。
查阅资料:(1)蚁酸化学名称为甲酸( HCOOH),熔点为 8.6℃,一定条件下加热分解生成
两种物质;
( 2 ) 常 温 下 , 氯 化 钯 ( PdCl2 ) 溶 液 常 用 于 检 验 CO 的 存 在 :
CO PdCl H O CO Pd
2
2
2
(
灰色
) 2HCl
。
探究Ⅰ:蚁酸的酸碱性
【进行实验】向盛有蚁酸溶液的试管中滴加石蕊试液,变红色,结论:___________________。
【链接】当被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质你选择的是
______________(填字母)。
a.肥皂水
b.食醋
c.食盐水
探究Ⅱ:蚁酸的分解产物
【设计实验】常温下,在一定条件下加热蚁酸应选择装置____________(填“A”或“B”);
【进行实验】将分解产物通入 C 处空瓶,实验中观察到 D 处瓶内出现灰色沉淀,结论:分
解产物中有___________________,同时可观察到 C 处瓶内的现象是_______________,写
出蚁酸分解的化学方程式____________________。
�
探究Ⅲ:产物的性质
【拓展实验】排尽装置内的空气后,关闭 K2,打开 K1,点燃酒精喷灯,F 处玻璃管内的现象:
____________________,结论:一氧化碳具有还原性;此时 H 处瓶内无明显现象,证明二
氧化碳在 G 处被完全吸收,分析该装置存在的缺陷:___________________;然后打开 K2,
关闭 K1,Ⅰ处装置的作用是_____________________。
14.(5 分)人体所需的维生素 C(化学式为 C6H8O6)主要从蔬菜、水果中摄取,计算:
(1)维生素 C 中碳、氢、氧三种元素质量的最简整数比为______________________。
(2)现有溶质质量分数为 1%的维生素 C 的溶液 300g,若配制成溶质质量分数为 0.3%的维
生素 C 的溶液,问需要加水的质量是多少。(写出计算过程)
参考答案
1--8:BABC
ABDC
9.(5 分):(1)Al
(2)隔绝空气和水
(3)b
(4)硝酸锌、硝酸铜
10(4 分):(1)b
(2)t1
(3)b
11.(6 分):(1)Ca
O
(2)CaCO3【CaO 或 Ca(OH)2】
(3)生石灰和水反应生成具有腐蚀性的氢氧化钙并放出大量的热(合理即可)。
CO CaCO
2
H O
2
3
(4)
Ca (OH)
2
(5)44
12.(5 分):(1)
(2)单质
(3)SO3
(4) 2
4
H SO 2NaOH Na SO 2H O
4
2
2
(合理即可);
13.(9 分):探究Ⅰ:蚁酸溶液显酸性;
a
探究Ⅱ:B;CO;有大量水珠出现;
HCOOH
浓硫酸
CO
H O
2
(可不写条件)。
�
探究Ⅲ:固体由红色逐渐变成黑色;一氧化碳排放到空气中会造成污染(合理即可);收集
纯净的一氧化碳气体(合理即可)。
14.(5 分):(1)9:1:12
(2)解:设:需加水的质量为 x
300g 1% (300g x)*0.3%
*
由题意:
X=700g
答:略。
�












 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc