2007 年浙江普通高中会考化学考试真题
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共 6,有 4 大题,35 小题,满分为 100 分。考试时间 90 分
钟。
2.本卷答案必须做在答卷Ⅰ、Ⅱ的相应位置上,做在试卷上无效。
3.请用铅笔将答卷Ⅰ上的准号和学科名称所对应的括号或方框涂黑,用钢笔或圆珠笔将姓名、准考证
号分别填定在答卷Ⅰ、Ⅱ的相应位置上。然后再开始答题。
4.本卷可能用到的相对原子质量数据:H-1,C-12,O-16,Al-27,S-32,Ba-137。
一、选择题(本题有 28 小题,每小题 2 分,共 56 分。每小题只有 1 个选项符合题意,不选、多选、
卷 Ⅰ
错选均不给分)
1.美国劳伦斯—利弗莫尔国家实验室 2006 年 10 月宣布,该实验室科研人员与俄罗斯科学家台作,用
高速 Ca2+轰击处于旋转状态的锎原子( Cf
249
98 ),成功得到 118 号超重元素的原子。其中 Cf
249
98 原子核内的
质子数为
A.98
B.118
C.151
D.249
2.下列物质中,属于离子化合物的是
A.NaCl
B.HCl
C.CO2
D.N2
3.下列物质中,属于强电解质的是
A.水
B.铁
C.醋酸
D.氢氧化钠
4.下列物质中不属于危险品,允许旅客带上客车的是
A.浓硫酸
B.鞭炮
C.洗洁精
D.汽油
5.下列说法中,正确的是
A.摩尔是物质的质量单位
B.H2 的摩尔质量是 2g
C.1mol 任何气体的体积都是 22.4L
D.1molH2O 的质量是 18g
6.下列物质中,属于芳香烃的是
A.
B.
—OH
C.C2H6
D.C2H5OH
7.下列过程中,属于化学变化的是
A.石油分馏制汽油
B.液化空气分离制氮气
�
C.牛奶久置变酸
D.高分子分离膜浓缩天然果汁
8.下列物质的名称及对应的化学式(或分子式)均正确的是
A.硫酸铁—FeSO4
B.氯化氢—NH4Cl
C.金刚石—C
D. 甲醛—CH2O
9.小颖同学在家中探究蜡烛的成分。她点燃蜡烛,将白色瓷杯底紧贴火焰上方,过一会儿在杯底发现
有黑色物质。据此现象可推测蜡烛的组成中一定含有
A.氢元素
B.碳元素
C.氮元素
D.氧元素
10.普通铜—锌原电池的结构如右图,下列有关铜、锌电脑的描述正确的是
A.铜作负极
B.铜电极上发生氧化反应
C.锌作负极
D.锌电极上发生还原反应
11.食醋的主要成人是
A.C2H5OH
B.CH3COOH
C.CH3CHO
D.CH3COOC2H5
12.下列关于硝酸性的认识,不正确的是
A.是一种强酸
B.浓硝酸见光易分解
C.硝酸不能与铜反应
D.常温下,浓硝酸可使铝发生钝化
13. 下列化学用语表达正确的是
A. 氮的原子结构示意图:
B.氯化氢的电子式:H+[:Cl..:]-
C.乙醛的结构简式:CH3CHO
D.蔗糖的分子式:C6H12O6
14.铝热反应(如
2Al
OAl高温OFe
2
2
3
2Fe
3
)中,铝的作用是
A.还原剂
B.氧化剂
C.催化剂
D.干燥剂
15.在以下 4 个反应中,铁元素的化合价变化与另外 3 个反应不同的是
S
FeS
Fe
A.
B.
3Fe
4H
(水蒸气
2
OFe Δ )
3
4H
2
4
C.
Fe
2HCl
2 H
2
FeCl
D.
Fe
CuSO
4
FeSO
Cu
4
16.一定条件下的密闭容器中,反应
CO(g)
H
O(g)
2
CO
2
(g)
(g)H
2
已达平衡。下列措施中可
使该平衡向正反应方向移动的是
�
A.通入 CO
B.通入 CO2
C.增大压强
D.减小压强
17.在用 NaCl 固体配制 250mL0.5mol·L-1NaCl 溶液的实验中,不需要使用的仪器是
18.某主族元素的气态氢化物的化学式为 RH3,此元素最高价氧化物对应水化物的化学式可能为
D.
A.H3RO3
B.HRO3
C.H2RO4
D.HRO4
19.解释或表示下列过程的方程式正确的是
A.CuCl2 溶液能导电:
CuCl
2
Cu
2
Cl
2
B.CH3COONa 溶液呈碱性:
CH
3
COO
OH
2
CH
COOH
OH
3
C.用盐酸和石灰反应制取 CO2:
CO
-2
3
2H
CO
OH
2
2
D.电石与水反应:
CaC
2
O2H
2
Ca(OH)
CH
2
CH
2
2
20.用含氧的同位素 O18
8 的乙醇与普通乙酸反应,所生成的乙酸乙酯的相对分子质量是
A.86
B.88
C.90
D.92
21.下列关于实验现象的描述不正确的是
A.铁丝在氯气中燃烧,生成棕黄色的烟
B.在 AlCl3 溶液中加入过量 NaOH 溶液,生成的沉淀不会消失
C.CH4 不能使 KMnO4 酸性溶液褪色
D.葡萄糖能与银氨溶液发生银镜反应
22.香兰素的结构简式如右图所示,它有宜人气味,存在于香草豆、安息香、丁子油中,是制作巧克
力的辅助原料。下列关于香兰素的说法中正确的是
A.含有 C、H、O 三种元素
B.属于烃类物质
C.不能发生银镜反应
D.不能与 NaOH 溶液反应
23.bL 硫酸铝溶液中含有 a gAl3+,则溶液中
2
4SO 的物质的量浓度为
A.
3a
2b
mol
·L-1
B.
a
27b
mol
·L-1
�
C.
a
18b
mol
·L-1
D.
2a
27
3b
mol
·L-1
24.pH=13 的某溶液中,不能大量存在的离子为
A.Na+
B.Fe3+
C.Cl-
D.OH-
25.等物质的量的下列有机物完全燃烧,生成 CO2 的量最多的是
A.CH4
B.C2H6
C.C3H6
D.C6H6
26.下列实验操作中,正确的是
A.稀释农 H2SO4 时,将蒸馏水沿容器内壁缓慢倒入浓 H2SO4 中,并及时搅拌
B.测定溶液 pH 时,用洁净的玻璃棒蘸取待测点在 pH 试纸上,观察试纸的颜色变化,并与标准比色卡
相比较
C.称量 NaOH 固体时,将 NaOH 固体放在垫有滤纸的托盘上
D.在蒸发 NaCl 溶液得到 NaCl 晶体的实验中,必须待蒸发皿中的水分全部蒸干后才槿撤去酒精灯
27.下列说法正确的是
A.炼铁过程中,铁元素被还原
B.所有金属都有良好的延展性
C.化学反应中的能量变化一定表现为热量的变化
D.实验室通常通过加热酒精和稀硫酸的混合物来制取乙烯
28.下列说法中,不正确的是
A.黏胶纤维是一种人造纤维
B.日常生活中的饮用矿泉水一定是混合物
C.并不是所有蛋白质跟浓硝酸反应都会产生黄色
D.目前还无法人工合成像叶绿素那样结构复杂的天然有机化合物
卷 Ⅱ
请将本卷的答案用蓝、黑色钢笔或圆珠笔与在答卷Ⅱ上。
二、填空题(本题有 3 小题,共 20 分)
29.(10 分)(1)写出乙烯通入溴的四氯化碳溶液中发生反应的化学方程式 ▲ ,该反应属于 ▲
反应。
(2)写出有有催化剂存在时,苯与液溴发生反应的化学方程式 ▲ ,该反应属于 ▲ 反应。
(3)写出氢氧化铝与盐酸反应的离子方程式 ▲ 。
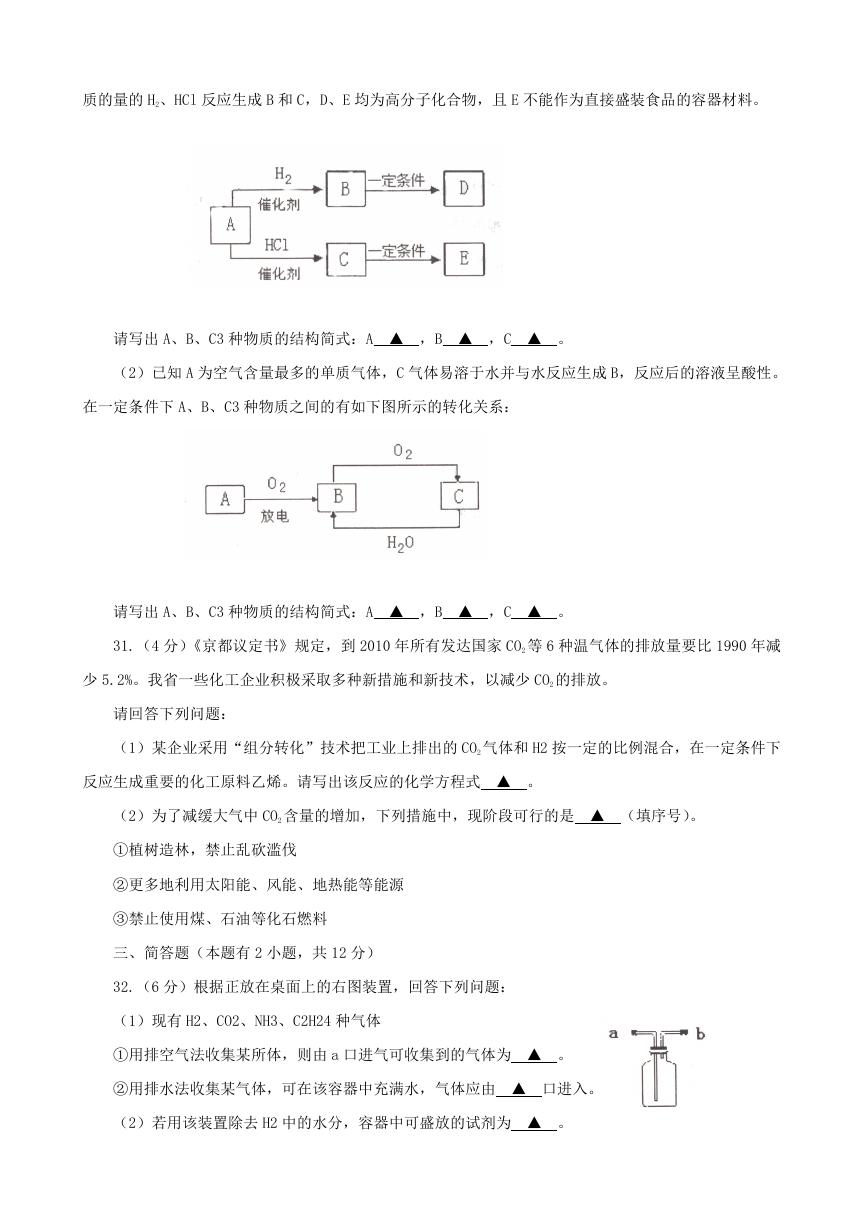
30.(6 分)[本题包括 2 小题,每位同学只需选做 1 小题。若两题都做,按第(1)小题计分。]
(1)有机物 A、B、C、D、E 之间有如下图所示的转化关系,已知 A 为最简单的炔烃,A 分别与等物
�
质的量的 H2、HCl 反应生成 B 和 C,D、E 均为高分子化合物,且 E 不能作为直接盛装食品的容器材料。
请写出 A、B、C3 种物质的结构简式:A ▲ ,B ▲ ,C ▲ 。
(2)已知 A 为空气含量最多的单质气体,C 气体易溶于水并与水反应生成 B,反应后的溶液呈酸性。
在一定条件下 A、B、C3 种物质之间的有如下图所示的转化关系:
请写出 A、B、C3 种物质的结构简式:A ▲ ,B ▲ ,C ▲ 。
31.(4 分)《京都议定书》规定,到 2010 年所有发达国家 CO2 等 6 种温气体的排放量要比 1990 年减
少 5.2%。我省一些化工企业积极采取多种新措施和新技术,以减少 CO2 的排放。
请回答下列问题:
(1)某企业采用“组分转化”技术把工业上排出的 CO2 气体和 H2 按一定的比例混合,在一定条件下
反应生成重要的化工原料乙烯。请写出该反应的化学方程式 ▲ 。
(2)为了减缓大气中 CO2 含量的增加,下列措施中,现阶段可行的是 ▲ (填序号)。
①植树造林,禁止乱砍滥伐
②更多地利用太阳能、风能、地热能等能源
③禁止使用煤、石油等化石燃料
三、简答题(本题有 2 小题,共 12 分)
32.(6 分)根据正放在桌面上的右图装置,回答下列问题:
(1)现有 H2、CO2、NH3、C2H24 种气体
①用排空气法收集某所体,则由 a 口进气可收集到的气体为 ▲ 。
②用排水法收集某气体,可在该容器中充满水,气体应由 ▲ 口进入。
(2)若用该装置除去 H2 中的水分,容器中可盛放的试剂为 ▲ 。
�
33.(6 分)乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙
醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)乙醇分子中的官能团是 ▲ 。
(2)在试管里加入 2mL 乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加
热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如
右图),取出铜丝,可以观察到铜丝表面 ▲ 。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙
醇汽油的好处是(写出一条即可) ▲ 。
四、计算题(本题有 2 小题,共 12 分)
34.(5 分)2006 年 5 月 15 日,国家食品药品监督管理局通报了因注射“亮菌甲素注射液”造成多位
病人死亡的严重后果,其主要原因是原料检验环节失控,用“二甘醇”替代“丙二醇”作为药用溶剂投料
生产。二甘醇有很强的毒性,它在人体内可被氧化成草酸而引起肾脏损伤。
二甘醇的相对分子质量为 106,其中碳和氧的质量分数相同,均约为 43.5%,其余为氢。请通过计算
写出二甘醇的分子式。
35.(7 分)在 NaOH 和 Ba(OH)2 的混合液中,逐滴加入 0.1mol·L-1H2SO4 溶液,加入 H2SO4 溶液的休积
与生成 BaSO4 沉淀的质量关系如下图所示。已知当加入 H2SO4 溶液 50 mL 时,溶液呈中性。请回答:
(1)当加入 H2SO4 溶液 20 mL 时,沉淀的质量刚好达到最大,此时溶液呈 ▲ 性。生成 BaSO4 沉淀
的质量是 ▲ g。
(2)原混合液中 NaOH 和 Ba(OH)2 的物质的量各多少(写出计算过程)?
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc