2013 年云南昆明理工大学冶金物理化学考研真题 A 卷
一、选择题。在题后括号内,填上正确答案代号。(本大题 15 小题, 每小题 2 分, 共 30
分)
1、热力学第一定律的数学表达式ΔU = Q + W 只能适用于:(
(1) 理想气体; (2) 封闭体系; (3) 孤立体系; (4) 敞开体系.
2、 一定量的某理想气体等容下由 T1 升温到 T2,相同量的该气体等压下也由 T1 升温到 T2,
则两个过程热量的关系和热力学能变化的关系为:(
)。
)。
( 1 ) QV = Qp,UV = Up;
( 3 ) QV Qp,UV Up;
( 2 ) QV Qp,UV = Up;
( 4 ) QV Qp,UV Up。
3、理想气体与温度为 T的热源相接触,作等温膨胀吸热 Q,而所作的功是变到相同终态的
最大功的 20 % ,则系统的熵变为(
(1) S
4、可逆过程是:(
Q
T
)。
)。
5 ; (2) S Q
; (3) S Q
5
T
T
; (4) S
Q
T
(1) 系统产生的变化可以完全复原的过程,
(2) 环境的变化可以完全复原的过程,
(3) 系统和环境的变化均可以完全复原的过程,
(4) 不可能使系统和环境都完全复原的过程.
5、已知 CH3COOH(l),CO2(g),H2O(l)的标准摩尔生成焓fH (298K) / kJ·mol-1 为-4845,
-3935,-2858,则 CH3COOH (l)的标准摩尔燃烧焓cH (298 K) / kJ·mol-1 = (
)。
(1)8741; (2)-8741; (3)-1948; (4)1948 。
6、100℃, 101.3 kPa 下, 液体水变成水蒸气的过程, 下列各式中, 不正确的是(
)。
(1)
A = 0, (2)
G = 0,
(3)
7、系统经某过程后,其焓变H = Qp,则该过程是(
S > 0, (4) H > 0
)。
( 1 )理想气体任何过程;
( 2 )理想气体等压过程;
( 3 )真实气体等压过程;
( 4 )封闭系统不作非体积功的等压过程。
8、指出关于亨利定律的下列几点说明中,错误的是:( )。
(1)溶质在气相和在溶剂中的分子状态必须相同;
(2)溶质必须是非挥发性溶质;
(3)温度愈高或压力愈低,溶液愈稀,亨利定律愈准确;
(4)对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其他
气体
的分压力无关。
9、已知反应 H2(g)+1/2O2(g)= H2O(l)的ΔH,下列说法中,何者不正确?(
(1) ΔH 为 H2O 的生成热;
(2) ΔH 为 H2 的燃烧热;
)。
(3)ΔH 与反应的ΔU 数值不等;
(4) ΔH 与 H $ 数值相等。
10、由 A 和 B 组成的二组分凝聚系统温度~组成图上, 处于低共熔温度以下的
系统, 其自由度数为:(
)。
(1) 0;
(2) 1;
(3)2;
(4)3.
�
11、反应 A
1 Y
2
3
产物) ,已知反应的活化能 E2 < E3 ,为利于产物 Z 的
Z(
P
生成,原则上选择:(
) 。
( 1 ) 升高温度;
( 3 ) 维持温度不变;
( 2 ) 降低温度;
( 4 ) 及时移走副产物 P。
12、朗克缪尔公式可描述:( )。
(1)五类吸附等温线;
(2)三类吸附等温线;
(3)两类吸附等温线;
(4)化学吸附等温线。
13、 已知 25℃时,$ (Fe3+| Fe2+) = 0.77 V,$ (Sn4+| Sn2+) =0.15 V。今有一电
池,其电池反应为 2 Fe3++ Sn2+=== Sn4++2 Fe2+,则该电池的标准电动势 E (298 K) 为:
( )。
(1)1.39 V;
(3)0.92 V;
(2)0.62 V;
(4)1.07 V。
14、在 25℃时,电池 Pb(Hg)(a1)|Pb(NO3)2(aq)|Pb(Hg) (a2)中 a1 a2,则其电动势 E:( )。
(1)0;
(2)0; (3)=0;
(4)无法确定。
15、在一支水平放置的洁净的玻璃毛细管中有一可自由移动的水柱,今在水柱右端微微加
热,则毛细管内的水柱将(
)。
(1)向右移动; (2)向左移动; (3) 不移动;(4)不能确定。
。
。
二、填空题。在题中“____”处填上答案。(本大题总计 15 分)
1、已知铁(Fe)的 Cp m=(1749 + 2477 10-3T/ K)J·mol-1·K-1,在等压下将 1 mol F
e 从 27℃加热至 327℃,则过程的S =
2、在 732 K 时,反应 NH4Cl(s) == NH3(g) + HCl(g) 的 rG =-20.8 kJ·mol-1,rH =
154 kJ·mol-1,则该反应的rS =
3、在保持温度 T及 101 325 Pa 压力条件下,PCl5(g) 在一带活塞的抽空汽缸中分解为 PC
l3(g) 与 Cl2(g) ,反应达平衡时,PCl5(g) 有 50%解离,此时系统的体积为 1dm3。试说明在
下列过程中 PCl5(g) 的解离度是增大、减小还是不变:若保持压力、温度不变下,于系统
内通入 N2(g) 直至体积为 2 dm3,此时
,然后在 T不变下加压,直至系统的体积回
至 1 dm3,则
,而整个过程的
4、过热液体的存在可用公式解释。
5、原电池 Ag | AgCl(s) | Cl || Ag+ | Ag 应该用做盐桥。
6、原电池 Hg | Hg2Cl2(s) | HCl | Cl2(p) | Pt,其负极的反应方程式为;
正极的反应式为。电池反应为。
三、问答题。请回答下列各题。(本大题共 2 小题, 共 30 分)
。(选填减小、增大、不变)。
1、(15 分)1. 简述原电池极化与电解池极化的区别。2. 25℃用 Pt 电极电解 HNO3 水溶液
,理论的分解电压是 1.229V,但实际上,当电解池的外加电压 E(外) =1.669 V 时,阴极及
阳极上才明显有氢气泡及氧气泡排出,试说明原因。
2、(15 分)合成氨反应为:
�
3H2(g) + N2(g) == 2NH3(g)
一般在 30 MPa,约 520 ℃时进行,生产过程中要经常从循环气(主要是 H2, N2, NH3, CH4)
中排除 CH4 气体,为什么?
四、计算题(共 75 分)
1、( 15 分) 25℃时,电池:
Pb s PbCl s KCl aq Hg Cl Hg l Pb(s)的电动势温
( )
( )
( )
(
)
2
2
2
度系数为
(
E )
pT
=1.45×10-4V·K-1。(1)写出电极反应和电池反应;(2)计算电池可逆放电
时的 Qr 及该电池反应的rGm,rSm ,rHm;(3)计算电池的电动势 E。
已知: fH (PbCl2, s)= 359.1 kJ·mol-1;
fH (Hg2Cl2, s)= 264.85 kJ·mol-1。
2、(10 分) 18.02g 水在 100℃,1013 kPa 下转变为 100℃,1013 kPa 的水蒸气,计算该
过程的 W、Q、U,H,S,A和G。已知水在 100℃的摩尔气化焓为 4071 kJ·mol-1,
设水蒸气可视为理想气体。H2O 的摩尔质量 M = 1802 g·mol-1。
3、(10 分) 对反应 PbO(s) + CO(g)
Pb(s) + CO2(g) 已知 25℃的数据如下:
物
质
fH / kJ·mol-1
fG / kJMmol-1
PbO (s)
- 219.2
-189.3
CO (g)
- 110.5
-137.3
Pb (s)
0
0
CO2 (g)
-393.5
-394.4
试求 25℃时反应的 K 。假定该反应的rH 在 25~125℃间不随温度变化,求 125℃时反应
的 K 。
4、( 10 分) 在 298K 时, 2
( )
N O g
5
( )
N O g
2
4
1
2
( )
O g
2
,该分解反应的半衰期 1 2
t
5.7
h
,
此值与
5N O g 的起始浓度无关。试求:(1)该反应的速率常数;(2)
2
5N O g 转化掉 90%
2
所需的时间。
5、( 10 分) 20 ℃苯蒸气凝结成雾,其液滴半径为 1 m ,试计算其饱和蒸气压比正常
值增加的百分率。已知 20 ℃时液体苯的体积质量(密度)为 0.879 g·cm-3,表面张力为
0.0289 N·m-1 ,C6H6 的摩尔质量为 78.11 g·mol-1 。
�
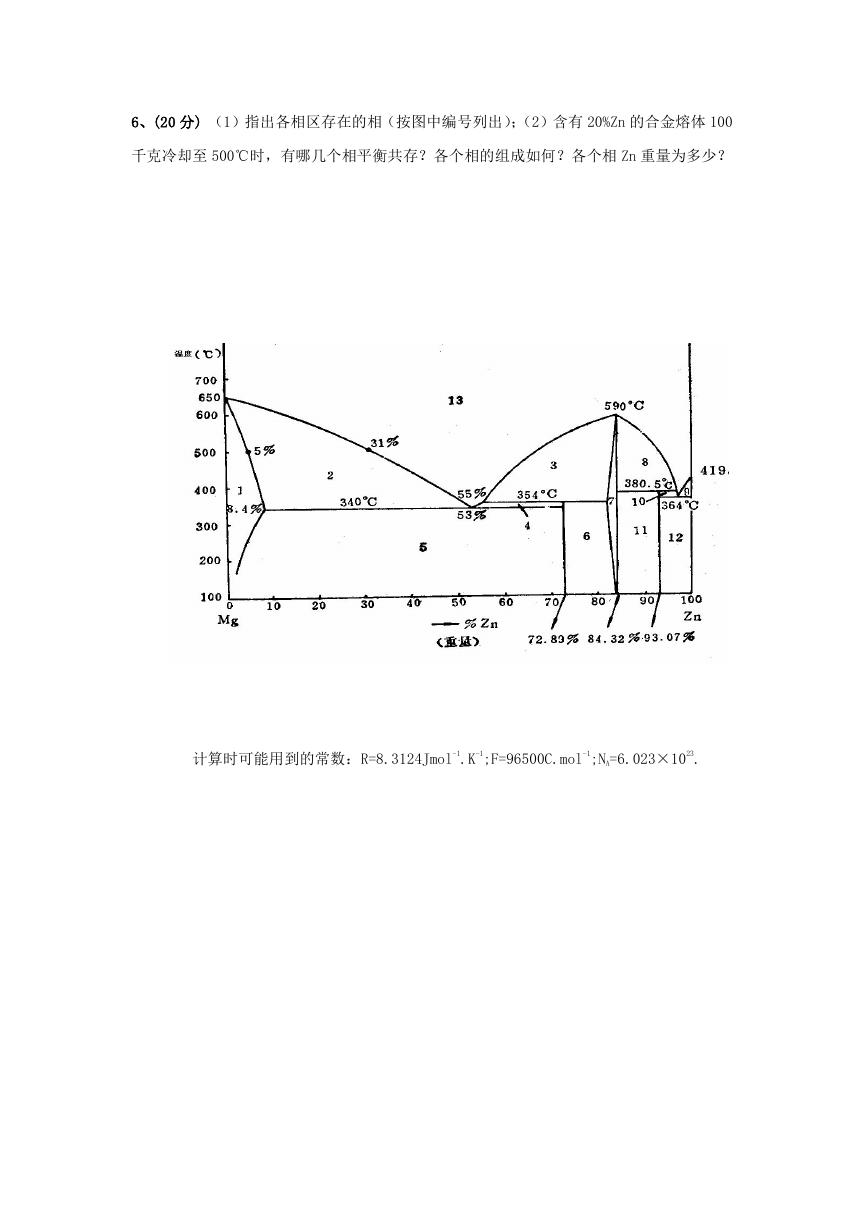
6、(20 分) (1)指出各相区存在的相(按图中编号列出);(2)含有 20%Zn 的合金熔体 100
千克冷却至 500℃时,有哪几个相平衡共存?各个相的组成如何?各个相 Zn 重量为多少?
计算时可能用到的常数:R=8.3124Jmol-1.K-1;F=96500C.mol-1;NA=6.023×1023.
�







 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc