2019 年四川省泸州市中考化学真题及答案
一、选择题
1.下列物质不溶于水的是
A.酒精
B.硝酸
C.蔗糖
D.铁锈
C.
Cu OH
2
D.
FeSO
4
2.下列物质不能与盐酸反应的是
A. Mg
B.
AgNO
3
3.下列说法错误的是
A. 2
2H O 属于氧化物
B.碳元素与氧元素位于同一周期
C.
NaNO 中氮元素的化合价为 5 价
2
D.1 个钠原子失去 1 个电子变成钠离子
(
(
(
)
)
)
4.下列叙述错误的是
(
)
A.氢氧燃料电池是将电能转换成热能的装置
B.人体必需元素长期摄入不足不利于健康
C.食品在霉变过程中发生了化学变化
D.油脂可在小肠中转化为脂肪酸和甘油
5.某品牌牛奶的营养成分如表所示,对 1 盒 250 mL 的牛奶,叙述正确的是
(
)
A.碳水化合物提供的能量为 288 kJ
B.维生素 D 有助于骨骼和牙齿的生长发育
C.含 Ca 单质的质量为128 mg
D.蛋白质在人体内仅转化为 2N 排出体外
6.下列装置有误或不能完成对应实验的是
(
)
�
A.用于过滤粗盐水
B.用于食盐水的蒸
C.用于实验室即关
中的泥沙杂质
发结晶
即停制取 2H
7.下列反应的化学方程式及其应用都正确的是
D.用于除去 2H 中
的 HCl 杂质
(
)
A.
B.
Fe O 4CO
3
4
3Fe 4CO
2
,工业上用于冶炼铁
BaCl H O CO
2
2
2
BaCO
3
2HCl
,用于制取透视检查胃肠的钡餐
C.
Al O
3
2
3Al+O ,工业上用于冶炼铝
2
D.
NaCl NH CO H O
3
2
2
NaHCO NH Cl
3
4
,用于制取复合肥料
8.以下是 2
Na CO 、
3
NaHCO 的溶解度表。下列说法中错误的是
3
(
)
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
3
2
Na CO 的溶解度
( g/100 g 水)
7.1
12.5
21.5
39.7
49.0
48.5
46.0
NaHCO 的溶解
度( g/100 g 水)
3
6.9
8.1
9.6
11.1
12.7
14.5
16.4
Na CO 溶液升温到 60℃,会析出晶体
3
A. 40℃饱和 2
B. 60℃的
C. 30℃ 的溶质质量分数为 25% 的 2
D. 20℃的饱和 2
3
NaHCO 溶液蒸干并充分灼烧,可得到
NaHCO 晶体
3
Na CO 溶液中通足量 2CO ,生成的
3
3
Na CO 溶液降温到 20℃,有晶体析出
NaHCO 会部分析出
3
二、填空题(本题共 3 个小题,每空 1 分,共 11 分)
9.如图为世界最长的跨海大桥——港珠澳大桥,于 2018 年 10 月 24 日正式通车,凸显了我国领先的造桥技术。
回答下列问题:
(1)建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是
,能导电的
是
。
(2)造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、
。
�
10.我国科学家屠呦呦因成功提取了青蒿素而获得 2015 年诺贝尔生理学或医学奖。青蒿素的使用在全世界
“拯救了几百万人的生命”。青蒿用乙醚浸泡可提取其有效成分青蒿素,再利用乙醚沸点低易分离的特点,
回收循环利用乙醚。回答下列问题:
(1)提取青蒿素的过程是
变化(填“物理”或“化学”)。
(2)青蒿素的分子式为 15
C H O ,则 1 个青蒿素分子中含有
22
5
个原子,其中碳元素与氧元素的质量
比为
。
11.1911 年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的
高速运动的粒子轰击金箔,发现:“大多数粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”
回答下列问题:
(1)1 个粒子由 2 个中子和 2 个质子构成,则粒子带
电(填“正”或“负”),1 个粒子与 1
个 He
4 原子构成上的差别是
。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断 a=
,b=
。
(3)根据实验现象中粒子“大多数”与“极少数”的对比分析,你能想象出关于 Au 原子结构的结论
是
。
三、实验与探究(本题共 2 个小题,每空 1 分,共 14 分)
12.已知: 2Na O 为白色,
Na O 为淡黄色; 2
Na O 2H O
2
2
2
2NaOH
。某兴趣小组对钠和铜的单质及其化
合物的性质进行了如下实验探究。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸
馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)步 骤 ① 产 生 的黑 色 物 质 是
,步 骤 ②淡 黄 色产 物 中 氧 元 素的 化 合 价 为
价。
(2)步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学
方程式为
。
(3)步骤③产生的气体物质为
。
�
(4)猜想步骤③还可能有一种常见物质
(填化学式)生成,向反应后的溶液中滴加
(可供选择的试剂: 2
H SO 、
4
CuSO 、 KOH 、 2
Na CO ),观察到
4
3
溶液
的现
象时,即证明了你的猜想。
13.已知:相同条件下,氨气的密度比空气小,极易溶于水,其水溶液称为氨水,溶质 3
NH H O
2
能解离出 NH
和 OH 。某同学对其制备与性质进行了如下探究。回答下列问题:
(1)氨气制取:固体 4NH Cl 与足量消石灰混合加热可以制取氨气。
①选择的发生装置是
,收集装置是
(选填大写字母)。
②结合选择的装置完成氨气的制取、收集并吸收氨气制取氨水,按气流顺序各装置的接口从左到右依
次为
(用小写字母表示)。
③充分反应后冷却,将残余固体转移到烧杯中,加水溶解,还需要的玻璃仪器是
,溶液中
的阳离子为
。
(2)性质探究:向滴加了酚酞试液的氨水中再滴加足量
3AlCl 溶液,观察到的现象是
,反应的化学
方程式为
。
四、计算题(本题共 2 个小题,除 15(2)②小题为 4 分外,其余每空 1 分,共 16 分)
14.水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答
下列问题:
(1)酸 雨
( 填 “ 能 ” 或 “ 不 能 ”) 污 染 水 体 ,煤 燃 烧 产 生 2SO ,
2SO 形 成 酸 雨 的 主 要 原 因
是
。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的
(填化学物质)结构破坏,失去生理活性。
(3)某工业废水含
为
4
HgSO ,可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式
(填“低于”或“高于”)铁的沸点。也可以向废水中加入 2Na S 溶液
,汞的沸点
形成沉淀而除去汞,该沉淀的化学式为
。
(4)甲厂污水含硫酸的质量分数为 0.98% ,其流速为 45 kg / s ,乙厂污水含烧碱的质量分数为 0.4% ,为排
放 达 标 , 现 将 两 厂 的 污 水 混 合 处 理, 反 应 的 化 学 方 程 式 为
,则 乙 厂 污 水 的 最 佳 流 速 为
kg / s 。
15.水与自然界中矿石长期接触,常含
Ca HCO 、
3 2
Mg HCO 等物质,导致钙离子、镁离子含量较多,称
3 2
之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,
�
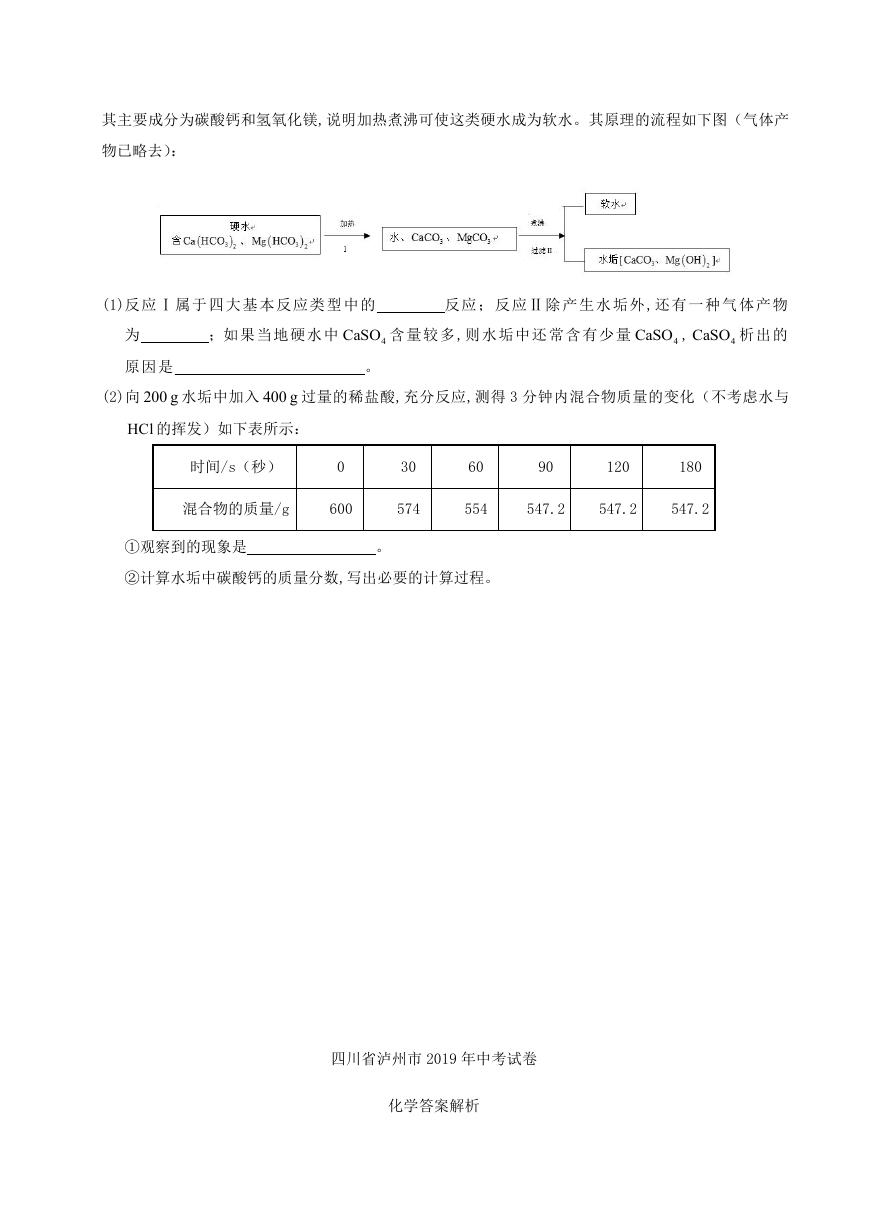
其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下图(气体产
物已略去):
(1)反 应 Ⅰ 属 于 四 大 基 本 反 应 类 型 中 的
反 应 ; 反 应Ⅱ 除 产 生 水 垢 外,还 有 一 种 气 体 产 物
为
;如 果 当地 硬 水 中
CaSO 含 量 较多 ,则 水 垢中 还 常 含 有 少量
4
CaSO ,
4
CaSO 析 出 的
4
原 因 是
。
(2)向 200 g 水垢中加入 400 g 过量的稀盐酸,充分反应,测得 3 分钟内混合物质量的变化(不考虑水与
HCl 的挥发)如下表所示:
时间/s(秒)
0
30
60
90
120
180
混合物的质量/g
600
574
554
547.2
547.2
547.2
①观察到的现象是
。
②计算水垢中碳酸钙的质量分数,写出必要的计算过程。
四川省泸州市 2019 年中考试卷
化学答案解析
�
一、选择题
1.【答案】D
【解析】A、酒精易溶于水,故选项错误。
B、硝酸易溶于水,故选项错误。
C、蔗糖易溶于水,故选项错误。
D、铁锈的主要成分是氧化铁,难溶于水,故选项正确。
故选:D。
【考点】溶液,浊液与溶解度
2.【答案】D
【解析】A、 Mg 能与盐酸反应生成氯化镁溶液和氢气,故选项错误。
B、
C、
AgNO 能与盐酸反应氯化银沉淀和硝酸,故选项错误。
Cu OH 能与盐酸反应生成氯化铜和水,故选项错误。
3
2
D、
FeSO 与盐酸不反应,故选项正确。
4
故选:D。
【考点】常见的酸,酸的通性
3.【答案】C
【解析】A、 2
2H O 由氢、氧两种组成的化合物,属于氧化物,故正确;
B、碳原子与氧原子都有两个电子层,碳元素与氧元素位于同第二周期,故正确;
C、
NaNO 中氮元素的化合价为 5 价,说法错误,根据化合价的原则:化合物中正负化合价的代数和为零,
2
求出
NaNO 中氮元素的化合价为 3 价,故错误;
2
D、钠原子最为层电子数为 1,容易失去 1 个电子变成钠离子,故正确。
故选:C。
【考点】物质的微观构成粒子和组成的知识
4.【答案】A
【解析】A.氢氧燃料电池是将化学能转换成电能的装置,故 A 错误;
B.人体必需元素长期摄入不足,会造成营养不良,不利于健康,故 B 正确;
C.食品在霉变过程中生成了其他物质是化学变化,故 C 正确;
D.在人体中,油脂主要在小肠中转化为脂肪酸和甘油被吸收,故 D 正确。
故选:A。
【考点】有机物的结构和性质
5.【答案】B
�
【解析】A.蛋白质、脂肪、糖类提供的总能量为 288 kJ ,故 A 错误;
B.维生素 D 有助于身体对钙元素的吸收,有助于骨骼和牙齿的生长发育,故 B 正确;
C.含钙元素的质量为128 mg ,故 C 错误;
D.蛋白质在人体内除转化为 2N 排出体外,还转化成 2CO 、 2H O 和尿素,故 D 错误。
故选:B。
【考点】化学与生活
6.【答案】C
【解析】A、过滤液体时,注意“一贴、二低、三靠”的原则;故正确。
B、根据蒸发操作的注意事项进行分析判断;故正确。
C、根据实验室即关即停制取 2H 装置的注意事项,进行分析判断;故错误。
D、图中装置起洗气功能时进气管与出气管的方向是“长进短出”;故正确。
【考点】常见仪器及化学实验基本操作
7.【答案】A
【解析】A、该化学方程式书写完全正确,工业上可用于冶炼铁,故选项正确。
B、氯化钡溶液不能与二氧化碳反应,故选项错误。
C、该反应氧化铝的化学式书写错误,故选项错误。
D 、 该 化 学 方 程 式 中 生 成 的 碳 酸 氢 钠 是 沉 淀 , 正 确 的 化 学 方 程 式 应 为
NaCl NH CO H O
3
2
2
NaHCO
NH Cl
4
3
,且氯化铵属于氮肥,故选项错误。
故选:A。
【考点】化学用语和质量守恒定律
8.【答案】B
【解析】A、 40℃到 60℃时,碳酸钠的溶解度随温度的升高而减小,所以 40℃的饱和 2
60℃,会析出晶体,故正确;
Na CO 溶液升温到
3
B、碳酸氢钠受热会分解,所以
NaHCO 溶液蒸干并充分灼烧,得到的是碳酸钠,故错误;
3
C、 20℃时碳酸钠的饱和溶液溶质质量分数为
21.5 g
100 g 21.5 g
100% 17.7%
,所以 30℃ 的溶质质量分数为
25% 的 2
Na CO 溶液降温到 20℃,有晶体析出,故正确;
3
3
Na CO 溶液中通足量 2CO 生成
D、 2
20℃时 2
NaHCO 会部分析出,故正确;
Na CO 的溶解度大于
3
3
NaHCO ,由化学方程式可知 2
Na CO 转化为
3
3
NaHCO 质量会增加,而
3
NaHCO 的溶解度,所以 20℃ 的饱和 2
Na CO 溶液中通足量 2CO ,生成的
3
3
�
故选:B。
【考点】溶液,浊液与溶解度
二、非选择题
9.【答案】(1)橡胶
钢材
(2)氧气、氯化钠
【解析】(1)橡胶是含碳元素的化合物,属于有机物;钢材是铁的合金,能导电。
(2)造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、氧气、氯化钠。
故答案为:
(1)橡胶;钢材;
(2)氧气、氯化钠。
【考点】金属与金属材料
10.【答案】(1)物理
(2)42
9 : 4
【解析】(1)青蒿用乙醚浸泡可提取其有效成分青蒿素,再利用乙醚沸点低易分离,过程中没有新物质生
成,属于物理变化;故填:物理;
(2)一个青蒿素分子由 15 个碳原子、22 个氢原子和 5 个氧原子构成,则一个青蒿素分子中含有 42 个原子。
青蒿素中碳元素与氧元素的质量比为
。故填:42; 9 : 4 。
12 15 : 16 5
9: 4
【考点】化学式的计算
11.【答案】(1)正
粒子中没有电子,1 个 He
4 原子中含有 2 个电子
(2)2
1
(3)相对原子来说,原子核很小,原子质量主要集中在原子核上
【解析】(1)1 个粒子由 2 个中子和 2 个质子构成,则粒子带正电,1 个粒子与 1 个 He
上的差别是:粒子中没有电子,1 个 He
故填:正;粒子中没有电子,1 个 He
4 原子中含有 2 个电子。
4 原子中含有 2 个电子。
4 原子构成
(2)第一层电子数最多是 2,因此 a
2 , b
故填:2;1。
79 2 8 18 32 18 1
。
(3)根据实验现象中粒子“大多数”与“极少数”的对比分析可知, Au 原子结构的结论是相对原子来
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc