2023 年湖南普通高中学业水平选择性考试化学真题及答案
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有
一项是符合题目要求的。
1. 中华文化源远流长,化学与文化传承密不可分。下列说法错误的是
A. 青铜器“四羊方尊”的主要材质为合金
B. 长沙走马楼出土的竹木简牍主要成分是纤维素
C. 蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化
D. 铜官窑彩瓷是以黏土为主要原料,经高温烧结而成
2. 下列化学用语表述错误的是
A. HClO 的电子式:
B. 中子数为 10 的氧原子: 18
8 O
C. NH3 分子的 VSEPR 模型:
D. 基态 N 原子的价层电子排布图:
3. 下列玻璃仪器在相应实验中选用不合理的是
A. 重结晶法提纯苯甲酸:①②③
B. 蒸馏法分离 CH2Cl2 和 CCl4:③⑤⑥
C. 浓硫酸催化乙醇制备乙烯:③⑤
D. 酸碱滴定法测定 NaOH 溶液浓度:
④⑥
4. 下列有关物质结构和性质的说法错误的是
A. 含有手性碳原子的分子叫做手性分子
�
B. 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C. 酰胺在酸或碱存在并加热的条件下可发生水解反应
D. 冠醚(18-冠-6)的空穴与 K+尺寸适配,两者能通过弱相互作用形成超分子
5. 下列有关电极方程式或离子方程式错误的是
A. 碱性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH-
B. 铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+
C. K3[Fe(CN)6]溶液滴入 FeCl2 溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
D. TiCl4 加入水中:TiCl4+(x+2)H2O=TiO2·xH2O↓+4H++4Cl-
6. 日光灯中用到的某种荧光粉的主要成分为 3W3(ZX4)2·WY2。已知:X、Y、Z 和 W 为原子序
数依次增大的前 20 号元素,W 为金属元素。基态 X 原子 s 轨道上的电子数和 p 轨道上的电
子数相等,基态 X、Y、Z 原子的未成对电子数之比为 2:1:3。下列说法正确的是
A. 电负性:X>Y>Z>W
B. 原子半径:X
下列说法错误的是
A. 溴化钠起催化和导电作用
B. 每生成1mol 葡萄糖酸钙,理论上电路中转移了 2mol 电子
C. 葡萄糖酸能通过分子内反应生成含有六元环状结构的产物
D. 葡萄糖能发生氧化、还原、取代、加成和消去反应
9. 处理某铜冶金污水(含
2
Cu
Fe
、 、 、 )的部分流程如下:
3
3
2
Zn
Al
已知:①溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示:
物质
Fe OH
3
Cu OH
2
Zn OH
2
Al OH
3
开始沉淀 pH 1.9
完全沉淀 pH 3.2
4.2
6.7
6.2
8.2
3.5
4.6
②
sK CuS
p
6.4 10
36
, K ZnS
s
p
1.6 10
24
。
下列说法错误的是
A. “沉渣Ⅰ”中含有
Fe(OH) 和
3
Al(OH)
3
B.
2Na S 溶液呈碱性,其主要原因是 2
S
H O
2
C. “沉淀池Ⅱ”中,当 2Cu 和 2Zn 完全沉淀时,溶液中
D. “出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
HS OH
c Cu
c Zn
2
2
4.0 10
12
�
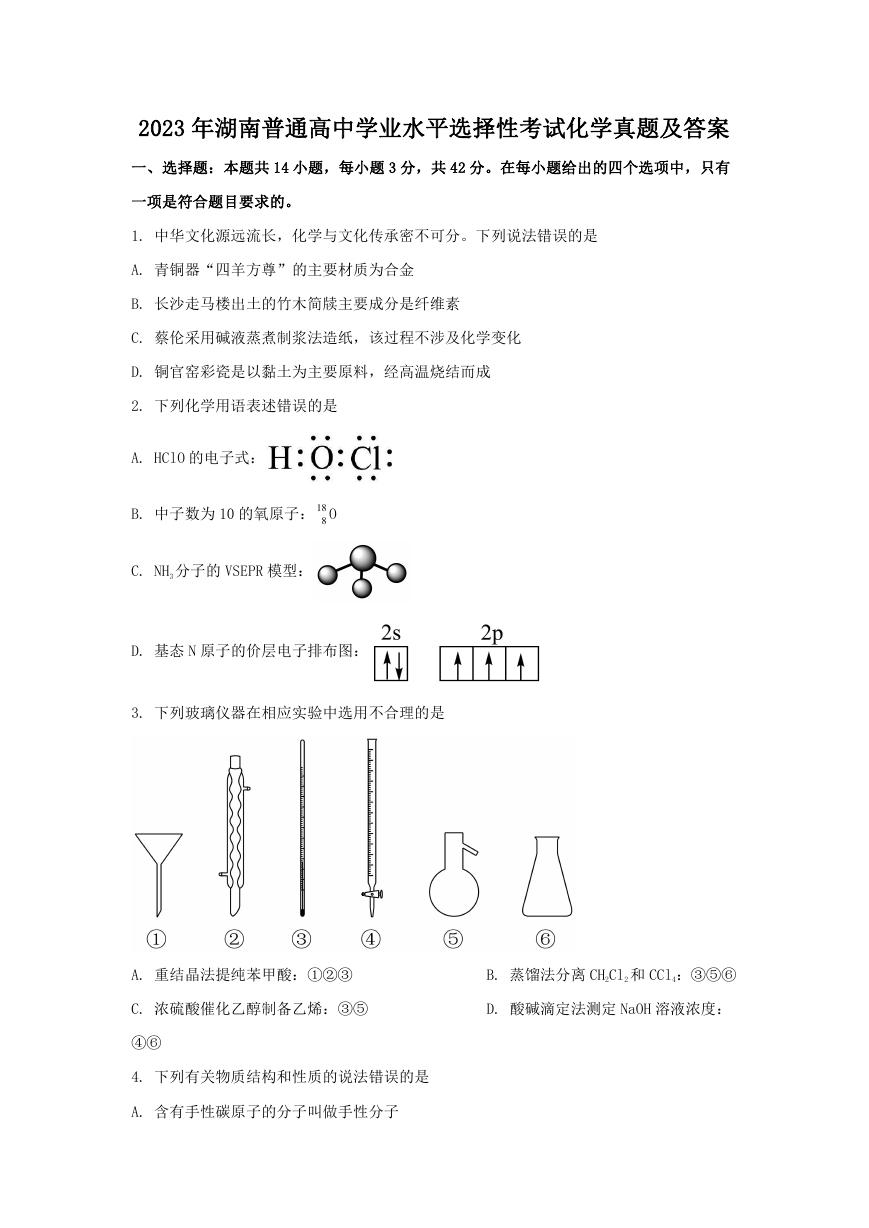
10. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜
料雌黄
2 3As S 褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A.
2
3S O 和 2
2
4SO 的空间结构都是正四面体形
B. 反应Ⅰ和Ⅱ中,元素 As 和 S 都被氧化
C. 反应Ⅰ和Ⅱ中,参加反应的
n O
n H O :Ⅰ<Ⅱ
2
2
D. 反应Ⅰ和Ⅱ中,氧化
1molAs S 转移的电子数之比为 3∶7
2 3
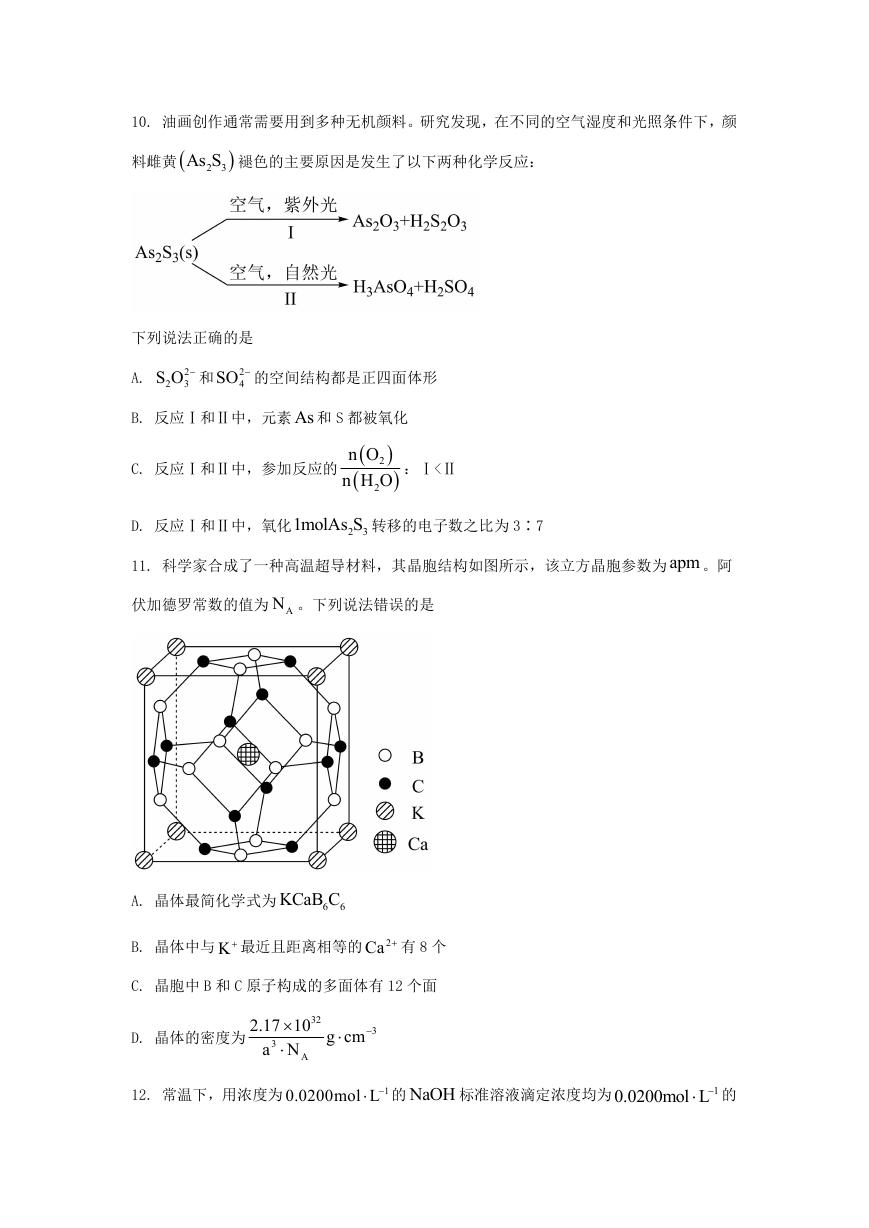
11. 科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为 apm 。阿
伏加德罗常数的值为 AN 。下列说法错误的是
A. 晶体最简化学式为
KCaB C
6
6
B. 晶体中与 K 最近且距离相等的 2Ca 有 8 个
C. 晶胞中 B 和 C 原子构成的多面体有 12 个面
D. 晶体的密度为
32
2.17 10 g cm
3
a N
A
3
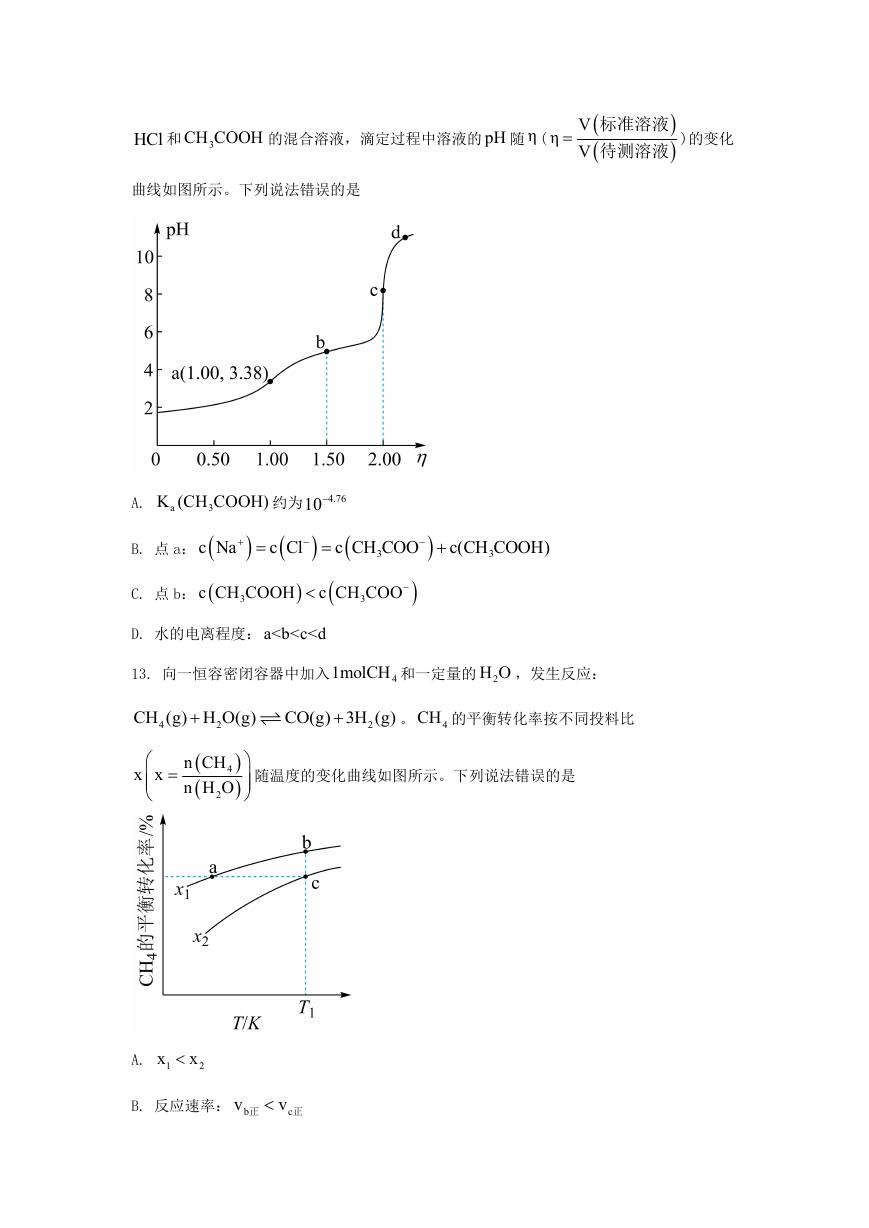
12. 常温下,用浓度为
0.0200mol L
的 NaOH 标准溶液滴定浓度均为
1
1
0.0200mol L
的
�
HCl 和 3CH COOH 的混合溶液,滴定过程中溶液的 pH 随 η (
η
V
V
标准溶液
待测溶液
)的变化
曲线如图所示。下列说法错误的是
(
a
A.
K CH C
B. 点 a:
C. 点 b:
10
OOH) 约为 4.76
c CH COO
c CH COOH c CH COO
c Cl
c Na
3
3
3
3
c(CH COOH)
3
D. 水的电离程度: a
C. 点 a、b、c 对应的平衡常数: a
K
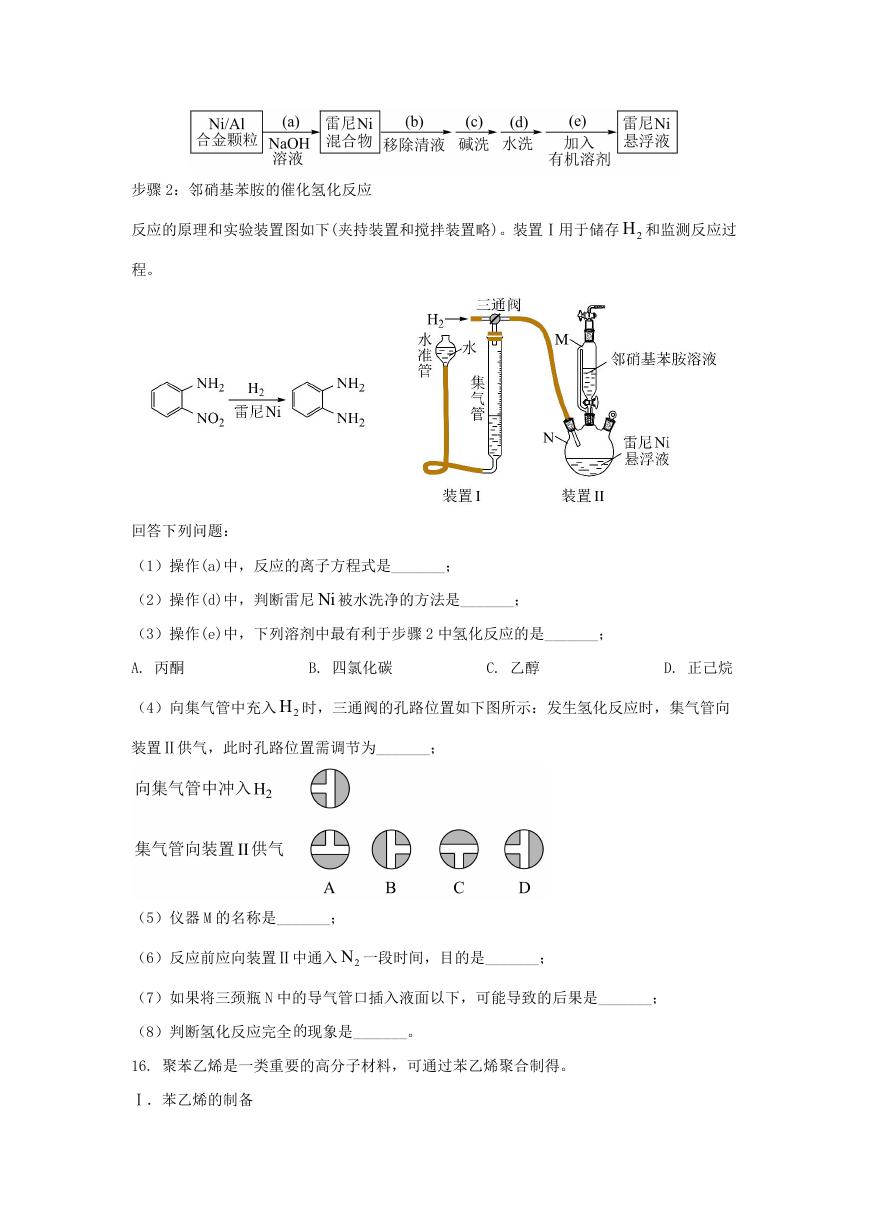
步骤 2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存 2H 和监测反应过
程。
回答下列问题:
(1)操作(a)中,反应的离子方程式是_______;
(2)操作(d)中,判断雷尼 Ni 被水洗净的方法是_______;
(3)操作(e)中,下列溶剂中最有利于步骤 2 中氢化反应的是_______;
A. 丙酮
B. 四氯化碳
C. 乙醇
D. 正己烷
(4)向集气管中充入 2H 时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向
装置Ⅱ供气,此时孔路位置需调节为_______;
(5)仪器 M 的名称是_______;
(6)反应前应向装置Ⅱ中通入 2N 一段时间,目的是_______;
(7)如果将三颈瓶 N 中的导气管口插入液面以下,可能导致的后果是_______;
(8)判断氢化反应完全的现象是_______。
16. 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
�
(1)已知下列反应的热化学方程式:
C H C H g
2
5
6
5
21
2
O g
2
8CO g
2
5H O g Δ
2
H
1
4386.9kJ mol
1
C H CH CH g
6
5
2
10O g
2
8CO g
2
4H O g Δ
2
H
4263.1kJ mol
1
2
①
②
③
H g
2
计算反应④
O g H O g Δ
2
1
2
6C H C H g
5
5
2
2
H
3
241.8kJ mol
1
C H CH CH g H g
2
5
2
6
的 4H _______
kJ mol
1
;
(2)在某温度、100kPa 下,向反应器中充入1mol 气态乙苯发生反应④,其平衡转化率为
50%,欲将平衡转化率提高至 75%,需要向反应器中充入_______ mol 水蒸气作为稀释气(计
算时忽略副反应);
(3)在 913K 、100kPa 下,以水蒸气作稀释气。 2 3
Fe O 作催化剂,乙苯除脱氢生成苯乙烯
外,还会发生如下两个副反应:
C H C H (g)
⑤ 6
2
5
5
C H (g) CH CH (g)
6
6
2
2
C H C H (g) H (g)
⑥ 6
2
2
5
5
C H CH (g) CH (g)
6
5
3
4
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性
S(S
转化为目的产物所消耗乙苯的量
已转化的乙苯总量
100%
)随乙苯转化率的变化曲线如图所示,
其中曲线 b 代表的产物是_______,理由是_______;
(4)关于本反应体系中催化剂 2 3
Fe O 的描述错误的是_______;
A. X 射线衍射技术可测定 2 3
Fe O 晶体结构
�












 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc