2018 年内蒙古阿拉善中考化学真题及答案
可能用到的相对原子质量:
H-1 C-12 N-14
O-16
Na-23
S-32
C1-35.5 K-39 Ca-40
一、选择题
1. 物质的下列用途主要利用其化学性质的是
A.液氧(支持燃烧)
B.金属铜(制电线)
C.活性炭(做防毒面具的吸附剂)
D.不锈钢(做水壶)
A. A
B. B
C. C
D. D
【答案】A
2. 分类法是学习和研究物质的一种重要方法,下列分类正确的是
A. 生铁、黄金、金刚石——合金
B. 纯碱、烧碱、熟石灰——碱
C. 氮气、红磷、铝—— 单质
D. 水、干冰、氯酸钾——氧化物
【答案】C
3. 下列有关说法正确的是
A. 氧气、二氧化碳和过氧化氢三种物质中都含有氧分子
B.
表示的粒子都是阴离子
C. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
D. 硝酸钾、氯化钠和硫酸铵三种物质在 pH=10 的溶液中能大量共存
【答案】B
4. 下列有关叙述正确的是
A. 分离 Zn 和 Fe 的固体混合物,加适量的 FeSO4 溶液后过滤
B. 除去 CO2 气体中混有的 HCl 气体,依次通过足量的 NaOH 溶液和浓硫酸
C. 配制 50g 质量分数为 6%的 NaOH 溶液,将 NaOH 固体放到纸上称量,再用 50mL 量简量取
水
D. 鉴别 NaOH 溶液、Ca(OH)2 溶液和稀硫酸,可用一种试剂一次鉴别
�
【答案】D
5. 有一不纯的 Na2CO3 样品,杂质可能是 K2CO3、CaCO3、FeCl3 和 NaCl 中的一种或几种,取该
样品 10.6g,加入足量稀盐酸完全反应后得到无色容液,同时产生 4.48 气体,下列判断正
确的是
A. 杂质一定有 FeCl3 和 CaCO3
B. 杂质一定没有 NaCl
C. 杂质可能是 K2CO3、CaCO3、NaCl 组成的
D. 杂质可能是 K2CO3 和 NaCl 组成的
【答案】C
6. 下表中,有关量的变化图像与其对应叙述相符的是
A
B
C
D
浓硫酸敞口放置一
向一定质量的氧化铁粉末中加
向一定质量的二氧化锰中加入过
向一定质量
AgNO3 和
Cu(NO3)2 的混
合溶液中加入
Zn 粉
氧化氢溶液
段时间
入稀盐酸
A. A
B. B
C. C
D. D
【答案】B
二、非选择题
7. (1)用化学式填空:石墨______ ;改良酸性土壤的碱_________。
(2)火箭推进器中装有液态肼(N2H4)和过氧化氢,当它们混合反应时,放出大量的热量,同时
产生一种气态单质和-种常见的液体,写出有关反应的化学方程式_______________。
(3)在一定条件下,A 和 B 两种物质发生反应生成 C 和 D。下图为该反应的微观示意图。
�
①从微观角度分析该反应的实质是______________。
②该反应中,生成 C 和 D 的质量比是___________。
(4)在托盘天平(灵敏度极高)两边各放盛有等质量、等质量分数足量稀硫酸的烧杯,天平平
衡。向左烧杯中加入一定质量的金属 M,同时向右烧杯中加入相同质量的金属 N,观察到从
反应开始至结束天平指针始终偏向右边(注:反应中都生成十 2 价的硫酸盐)。则:
①M、N 两种金属的活动性由强到弱的顺序为____________。
②M、N 两种金属的相对原子质量由大到小的顺序为__________。
【答案】
(1). C
(2). Ca(OH)2
(3). N2H4+2H2O2=N2↑+4H2O
(4). 在化学变化
中分子可分,原子不可再分
(5). 14: 3
(6). M
N
(7). N
M
8. 根据下图回答问题:
(1)实验室用高锰酸钾制取并收集较纯净的氧气,应选用的装置是________(填字母)。向气体
发生装置内加入药品前应进行的操作是____________。
(2)实验室用石灰石和稀盐酸反应制取二氧化碳时,可选用发生装置 A 或 G,G 与 A 相比较,
其优点是_________;若用 F 装置收集二氧化碳,检验二氧化碳已收集满的方法是______。
如果要证明制取二氧化碳实验后的废液呈酸性,可选用的试剂是_______(填字母)。
a.紫色石蕊溶液
b.石灰石
c.氢氧化钠溶液
d.硝酸银溶液 e.铜
【答案】
(1). BE
(2). 检查装置的气密性
(3). 可控制反应的发生与停止
(4). 将燃着的木条放在 b 导管ロ处,若木条熄火,证明巳收集满
(5). ab
9. 有一包固体,可能含有 NaCl、NaOH、Na2CO3、Na2SO4、MgCl2 中的一种或几种。为确定其
组成,取少量固体加足量水溶解得到无色溶液 M,进行下图实验。
�
试推断:
(1)白色沉淀 B 是______ (填化学式)。
(2)原固体中一定含有的物质是_______。
(3)无色滤液 2 中一定含有的阳离子是__________(填离子符号)。
(4)通过上述实验可知还有一种物质不能确定是否存在,为进-步确定,应采用的方法是____。
【答案】
(1). AgCl
(2). NaOH、Na2SO4
(3). Na+、H+、Ba2+
(4). 方法一:将
上述实验中的稀盐酸改成稀硝酸
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的 Ba(NO3)2 溶液,过滤,
取滤液滴加适量的 AgNO3 溶液,如果产生白色沉淀,证明有 NaCl
10. 为探究 CuO 和稀硫酸反应后溶液中溶质的成分,同学们设计了实验、歩驟如下:
(1)取少量 CuO 粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液 A。
(2)向歩驟(1)的試管中滴加 BaCl2 溶液,有白色況淀生成。得出结论:A 中溶质只有 CuSO4。
有同学认为该结论不合理,继续迸行实验。
(3)向歩驟(2)的武管中滴加 NaOH 溶液,产生沉淀质量随加入 NaOH 溶液貭量的変化关系如图。
回答下列问题:
①A 中的溶质有_____(填化学式),b~c 之间的沉淀是___________。
②c 点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要
考虑____________。
【答案】
(1). CuSO4、H2SO4
(2). BaSO4、Cu(OH)2
(3). NaCl 或 NaCl、Na2SO4 或
NaCl、BaCl2
(4). 反座物是否有剩余
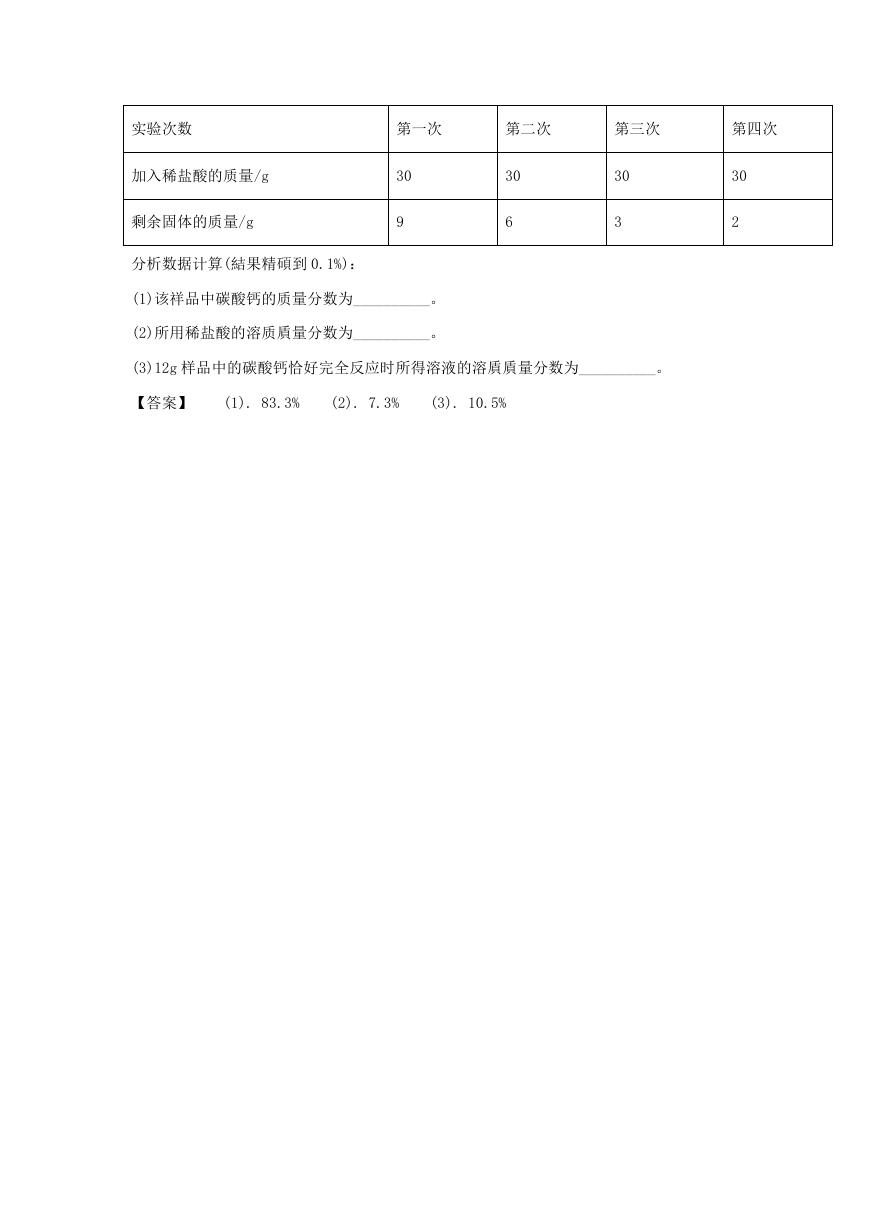
11. 某兴趣小組为测定石灰石中碳酸钙的貭量分数,取 12g 石灰石样品加入烧杯中,将 120g
稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
�
实验次数
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
剩余固体的质量/g
30
9
30
6
30
3
30
2
分析数据计算(結果精碩到 0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质貭量分数为__________。
(3)12g 样品中的碳酸钙恰好完全反应时所得溶液的溶貭貭量分数为__________。
【答案】
(1). 83.3%
(2). 7.3%
(3). 10.5%
�









 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc