2022 年湖北宜昌中考化学试题及答案
(本试题共 50 题,满分 115 分,考试时间 150 分钟。)
注意事项:
本试卷分试题卷和答题卡两部分,请将答案写在答题卡上每题对应的答题区域内,写在试题
卷上无效。
考试结束,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H~1
N~14
O~16
C1~35.5 Fe~56
Cu~63.5 Zn~65
Ag~108
I 选择题
一、选择题(本大题共 15 题,每题只有一个符合题意的选项,请将这个选项前面的字母代
号用 2B 铅笔在答题卡上填涂。16~30 题为化学,每题 1 分)
16.下列活动主要涉及化学变化的是
A.放鞭炮
B.剪窗花
C.堆雪人
D.放风筝
17.医疗急救常用到的气体是
A.氮气
B.氧气
C.空气
D.二氧化碳
18.“共建清洁美丽世界”,我们在行动。下列做法不符合这一主题的是
A.拒绝使用一次性餐具
C.生活污水处理后排放
19.下列实验操作正确的是
B.超市购物自备购物袋
D.大量施用农药和化肥
A.倾倒液体
B.量液读数
�
C.滴加液体
D.蘸取液体
20.2021 年,科学家通过“化学/生化”途径,人工合成了淀粉。淀粉属于
A.糖类
B.油脂
C.蛋白质
D.维生素
21.学习安全知识,提高安全意识。下列做法正确的是
A.加热液体时试管口朝向无人处
B.霉变食物洗净加热后方可食用
C.室内着火时立即开窗排出烟雾
D.在天然气灶具下方安装报警器
22.我国化学家侯德榜学成归国,发明了制碱新法“侯氏制碱法”,所制纯碱属于
A.氧化物
B.酸
C.碱
D.盐
23.下列各图中●和○表示不同元素的原子,其中不能表示纯净物的是
A.
C.
B.
D.
24.右图是硫的原子结构示意图。下列说法正确的是
A.x 的值为 8
C.硫在元素周期表中位于第 6 周期
2X+H
25.硅是重要的半导体材料,
学反应之一。下列说法错误的是
B.硫的原子核带 16 个单位正电荷
D.硫原子易得到电子,变成阳离子
一定条件
3HC1+Si
(高纯)是工业制硅流程中的化
A.反应中元素种类不变
B.反应中各原子数目不变
C.X 的化学式是 SiHCI2
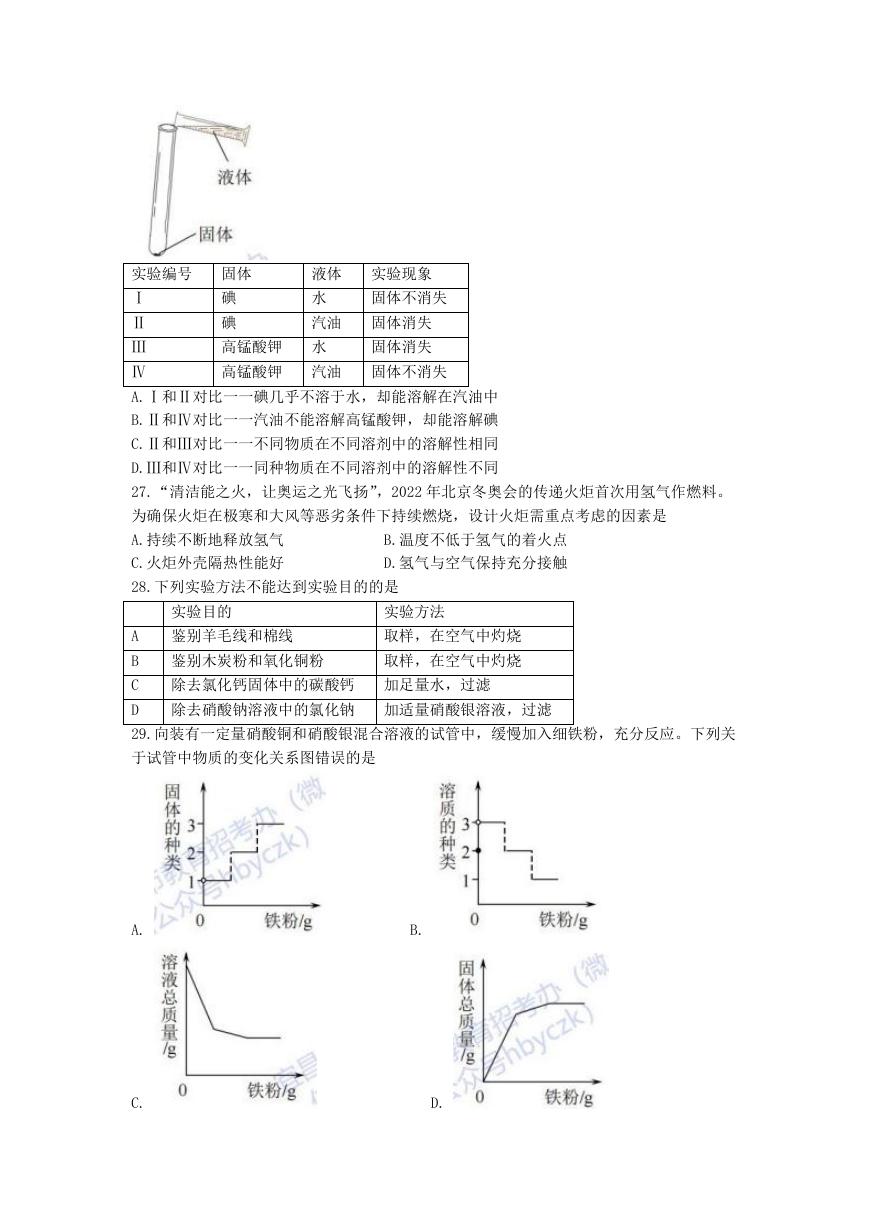
26.如下图所示,将 5mL 液体加入装有一小粒固体的试管中充分振荡,所得结论错误的是
D.副产品可用于生产盐酸
�
实验编号 固体
液体 实验现象
Ⅰ
Ⅱ
Ⅲ
Ⅳ
碘
碘
水
固体不消失
汽油 固体消失
高锰酸钾 水
固体消失
高锰酸钾 汽油 固体不消失
A.Ⅰ和Ⅱ对比一一碘几乎不溶于水,却能溶解在汽油中
B.Ⅱ和Ⅳ对比一一汽油不能溶解高锰酸钾,却能溶解碘
C.Ⅱ和Ⅲ对比一一不同物质在不同溶剂中的溶解性相同
D.Ⅲ和Ⅳ对比一一同种物质在不同溶剂中的溶解性不同
27.“清洁能之火,让奥运之光飞扬”,2022 年北京冬奥会的传递火炬首次用氢气作燃料。
为确保火炬在极寒和大风等恶劣条件下持续燃烧,设计火炬需重点考虑的因素是
A.持续不断地释放氢气
C.火炬外壳隔热性能好
B.温度不低于氢气的着火点
D.氢气与空气保持充分接触
28.下列实验方法不能达到实验目的的是
实验目的
实验方法
A
B
C
D
鉴别羊毛线和棉线
取样,在空气中灼烧
鉴别木炭粉和氧化铜粉
取样,在空气中灼烧
除去氯化钙固体中的碳酸钙 加足量水,过滤
除去硝酸钠溶液中的氯化钠 加适量硝酸银溶液,过滤
29.向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关
于试管中物质的变化关系图错误的是
A.
C.
B.
D.
�
30.甲、乙、丙是初中化学常见的物质,且类别相同(单质、氧化物、酸、碱、盐)。图中“→”
表示一种物质一步转化成另一种物质,部分反应物、生成物及反应条件未标出。下列说法与
图示关系不符的是
A.甲可以是硫酸
B.甲可以是氢氧化钙
C.①②③都可以是分解反应
D.①②③都可以是置换反应
Ⅱ非选择题
五、填空与简答题(本大题共 5 题,化学方程式每个 1 分,其余每空 0.5 分,共 14.5 分)
43.(2 分)用化学用语填空:
(1)2 个镁原子
。(2)氧化铝
。
(3)实验室常用澄清石灰水检验二氧化碳,反应的化学方程式为
。
44.(4 分)参加社会实践,提升科学素养。
(1)家务劳动。做凉拌皮蛋时,放入适量的食醋,主要目的是除去皮蛋中含有的
(填“酸”或“碱”)性物质。餐后利用洗涤剂的
作用清洗餐具油污。
(2)疫情防控。佩戴口罩能有效阻挡病毒的传播,其原理类似于化学实验中的
操作。测量体温时,水银温度计的汞柱随温度的升高而变长,其微观原因是
。
(3)研学实践。走进农田,给果树施化肥,该化肥是一种灰白色粉末,可能属于
肥(填“氮”“磷”或“钾”)。步入工厂,用除锈剂(主要成分是稀盐酸)给铁螺钉除锈,
反应的化学方程式为
。
(4)实践感悟。物质的
决定用途,化学在保证人类生存并提高生活质量方面
起着重要的作用。
45.(3 分)科技的发展,催生了许多新型化学工艺流程。
(1)上述流程对于解决能源问题有重大意义。
①反应 I 的化学方程式为
。
②将氢能储存在
(填化学式)中,解决了氢能源不便贮存和运输的问题。
(2)“碳中和”是指通过植树造林、节能减排等措施使二氧化碳的排放总量和减少总量相当。
上述流程中有利于实现“碳中和”,消耗二氧化碳的反应化学方程式为
。
(3)我们的下列做法中,有利于实现“碳中和”的是
。
A.减少车辆接送,步行上学
B.正反两面书写,节约用纸
C.勤洗手勤换衣,讲究卫生
D.垃圾分类投放,回收利用
46.(3 分)西汉刘安所著《淮南万毕术》记载的湿法炼铜术,表明我国是最早利用硫酸铜
的国家。
�
(1)微观认识:构成硫酸铜的粒子是
(填符号)。
(2)宏观分析:用硫酸铜炼铜的化学反应中,铜元素的化合价由
价变成
价。
(3)用途推测:硫酸铜是白色粉末,遇水变成蓝色,推测其用途为
。
(4)工业制法:
2H SO
方案一: 2
方案二:将废铜屑倒入稀硫酸中,控温 80℃并通入空气,生成硫酸铜和水。该反应的化学
+Cu CuSO +SO
(浓)
4
+2H O
4
2
2
方程式为
Cu+4HNO
。
(浓) ( )
方案三:
3
3 2
Cu NO +H SO CuSO +2HNO
请选出较好方案并阐述理由:
( )
3 2
2
4
4
3
Cu NO +2NO
2
2H O
2
。
47.(2.5 分)溶液与人们的生活息息相关。
(1)下表是两种物质在不同温度时的溶解度:
温度/℃
0
溶解度
氯化钾 27.6
/g
次氯酸
22.7
10
31.0
26.7
20
34.0
34.8
30
37.0
50.0
40
40.0
52.4
50
42.6
56.5
钠
1
2
3
0℃时,100g 水里最多只能溶解
g 氯化钾。
30℃时,将 30g 次氯酸钠加入到装有 50g 水的烧杯中,充分溶解后,所得溶液的质量是
g。将此溶液恒温蒸发 10g 水,烧杯中固体的质量为
g。
50℃时,将氯化钾和次氯酸钠的饱和溶液各 100g 分别降温至 20℃,两溶液中溶质的质
量大小关系是:氯化钾
次氯酸钠(填“大于”“等于”或“小于”)。
(2)我们常用含次氯酸钠的“84”消毒液定期对教室消毒。配制 2000g 质量分数为 0.05%
的消毒液,需要质量分数为 10%的“84”消毒液
g。
六、实验与探究题(本大题共 2 题,化学方程式每个 1 分,其余每空 0.5 分,共 11.5 分)
48.(5.5 分)氧气是人类不可离开的物质。根据下列装置图回答问题。
(1)实验室用氯酸钾制氧气的化学方程式为
,其发生装置可选用(填字每序
号,下同):用 C 装置收集氧气前,将集气瓶内空气完全排尽的方法是
。
(2)某同学欲按图 F 所示方法做细铁丝燃烧的实验,收集所需氧气最好选用的装置
是
;做硫燃烧实验,收集所需氧气最好选用的装置是
。由此可见,
选择气体的收集方法主要应考虑气体的性质,此外往往还要考虑
。
(3)如右图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
�
1 用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是
,反应的化学
方程式为
。
2 待红磷熄灭后再次称量,天平不再平衡,其原因可能是
。
A.装置漏气
C.红磷太少
B.用橡胶塞塞紧锥形瓶速度太慢
D.没有等锥形瓶冷却就再次称量
49.(6 分)运用化学知识,开展科学探究。
探究一、久置的物质能否继续使用
【实验探究】小明家中有久置的食品干燥剂(主要成分为生石灰)和消毒用双氧水(过氧化
氢溶液),为探究能否继续使用,在老师指导下,他与同学们在实验室探究如下:
食品干燥剂
消毒用双氧水
操作 取样于烧杯中,加适量水 取样于烧杯中,加适量二氧化锰
现象
结论 还能继续使用
没有气泡产生
反思与交流:久置的双氧水可能失效,反应的化学方程式为
。
探究二、某些酸、碱、盐之间能否发生反应
【实验探究】化学小组在实验过程中,部分记录如下表:
加了酚酞的氢氧化钠溶液 碳酸钠溶液 硝酸钡溶液
滴加稀硫酸 溶液呈红色
产生气泡
产生白色沉淀
反思与交流:
(1)有白色沉淀生成的反应化学方程式为
。
(2)甲同学认为硫酸与氢氧化钠没有发生反应,其理由是
;乙同学认为它们
发生了反应,只需从“试剂用量”角度作实验改进即可证明,其方法是
。
【废液处理】实验后的废液需进行无害化处理,使溶液呈中性且不含钡离子等。经讨论,同
学们将上述废液按下列步骤进行处理:
步骤 Ⅰ
Ⅱ
Ⅲ
IV
方法 将三组废液倒入同一烧杯中 静置 滴加足量的硫酸钠溶液 加过量的 X
现象 浑浊,产生气泡,红色消失 分层 无明显现象
……
反思与交流:
(1)步骤Ⅱ静置后的上层清液中,除酚酞外一定含有的溶质是
(填化学式,下
同):溶质种类最多时,溶质有
。
(2)步骤Ⅳ加过量 X 的目的用化学方程式可表示为
。
七、计算题(本大题共 1 题,共 4 分)
�
50.铜锌合金外观似金子,化学小组为检测其中锌的质量分数,按下列流程进行探究实验,
充分反应,所得数据如图所示(忽略盐酸的挥发):
求:(1)生成氢气的总质量为
g。
(2)合金中锌的质量分数。
(3)稀盐酸中溶质的质量分数。
�
一、
选择题(本大题共 15 题,每题只有一个选项符合题意,每题 1 分,共 15 分)
化学试题 参考答案
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
A
B
D
D
A
A
D
B
B
C
C
B
C
D
C
题
号
答
案
五、填空与简答题(本大题共 5 题,化学方程式每个 1 分,其余每空 0.5 分,共 14.5 分)
43.(2 分)(1)2Mg (2)A12O3 (3)
Ca OH +CO =CaCO +H O
( )
2
2
3
2
44.(4 分)(1)碱 乳化
(2)过滤 汞原子间的间隔随温度的升高而增大
(3)磷
45.(3 分)
6HCl+Fe O =2FeCl +3H O
2
3
3
2
(4)性质
2
②CH3OH
O
CH OH+H O
2- (2)+2 价变成 0 价 (3)检验水
(3)ABD
3
2
通电
2H
2
(1)① 2
2H O
CO +3H
2
催化剂
(2) 2
46.(3 分)(1)Cu2+、SO4
(4) 2
的利用率高
4
2
2H SO +2Cu+O 80 C2CuSO +2H O
4
2
方案二较好,安全、环保无污染、原料
47.(2.5 分)
(1)①27.6
②75
10
③大于
(2)10
六、实验与探究题(本大题共 2 题,化学方程式每个 1 分,其余每空 0.5 分,共 11.5 分)
48(5.5 分)(1)
2KC1O
3
2
MnO
(2)D
C 操作是否优化
(3)①冒白烟、放热、气球膨胀
2KC1+3O
2
A
将集气瓶装满水气
4P+5O
2
点燃
2P O
2
5
②ABD
49.(6 分)探究一
探究二【探究实验】(1) 2
(2)溶液颜色无明显变化
烧杯发热
H SO +Ba NO =BaSO
( )
3 2
不能继续使用
4
+2HNO
3
4
继续加稀硫酸至红色消失
2H O =2H O+O
2
2
2
2
【废液处理】(1)NaNO3
NaNO3、Na2SO4、H2SO4、HNO3
(2)
2HNO +CaCO =Ca NO +H O+CO
( )
3 2
3
3
2
2
七、计算题(本大题共 1 题,共 4 分)
50.(4 分)(1)0.2
(2)、(3)
解:设合金中锌的质量为 x,100g 稀盐酸中溶质的质量为 y。
Zn+2HC1=ZnC1 +H
2
65
73
2
2
x
65
x
2=
0.2g
y
0.2g
x=6.5g
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc