一、选择题
2011年广西来宾市中考化学真题及答案
1. 厨房里发生的下列变化属于物理变化的是( )
A . 菜刀生锈 B . 食盐溶解 C . 煤气燃烧 D . 米饭煮焦
2. 下列元素符号书写正确的是( )
A . 氟f B . 氖Ne C . 铝AL D . 钙ca
3. 衣服和床上用品所含的下列材料属于有机合成材料的是( )
A . 棉线 B . 麻线 C . 蚕丝 D . 涤纶
4. 下列关于空气的叙述正确的是( )
A . 空气是一种单质 B . 空气是一种化合物 C . 空气中氧气含量最多 D . 空气是一种混合物
5. 今年6月6日,浙江某高速公路上发生车祸,造成苯酚(显酸性)泄漏,污染新安江江水.当
地政府应向江水中投放的物质是( )
A . 食盐 B . 熟石灰 C . 硝酸钾 D . 稀盐酸
6. 1滴水中大约含有1.67×1021个水分子,这说明( )
A . 分子很小 B . 分子之间有间隔 C . 分子没有质量 D . 分子在不断地运动
7. 将下列物质放入水中,不能形成溶液的是( )
A . 白糖 B . 酒精 C . 苏打 D . 花生油
8. 发生水灾时,灾区人民要将浑浊的天然水净化饮用,他们采取的下列净化水的措施能杀死水
中有毒微生物并有效降低水硬度的是( )
A . 沉淀 B . 过滤 C . 煮沸 D . 投药消毒
9. 对质量守恒定律的下列理解正确的是( )
A . 根据质量守恒定律,100 g水冷冻后得到100 g冰 B . 根据质量守恒定律,1 g氢气和9 g氧
气充分反应能生成10 g水 C . 化学反应前后原子的种类、质量、数目均不变,故任何化学变化前后
质量守恒 D . 碳酸钠溶液和稀盐酸混合并反应后溶液总质量减小, 所以该变化不遵守质量守恒定
律
10. 人体缺乏某种微量元素会引起食欲不振、生长迟缓、发育不良.该元素是( )
A . 锌 B . 铁 C . 硒 D . 碘
11. 下列做法符合“低碳”理念的是( )
A . 少开机动车,多骑自行车 B . 少乘公交车,多开私家车 C . 少用太阳能,多用煤气 D . 讲
究卫生,推广一次性筷子
12. 房屋装修会产生大量废料,应将可利用的“垃圾”分类回收.下列废料应放入金属材料回收箱
的是( )
A . 废塑料水管 B . 废铝合金 C . 废包装纸 D . 碎砖块
13. 今年3月11日,日本发生里氏9.0级特大地震并引发海啸,造成福岛第一核电站发生核泄漏
事故.放射性物质中有碘元素的一种原子,它的相对原子质量为131,核内质子数为53.下列叙
述正确的是( )
A . 它的核内中子数为53 B . 它的核外电子数为78 C . 它的核内中子数与质子数之差为25 D .
它是一种金属元素
14. 氢气是一种优质新能源,但作为燃料暂时还不能广泛使用.主要原因是( )
A . 制取成本高且不易贮存 B . 不可再生且燃烧放热少 C . 制取氢气的原料很匮乏 D . 燃烧产
物有污染
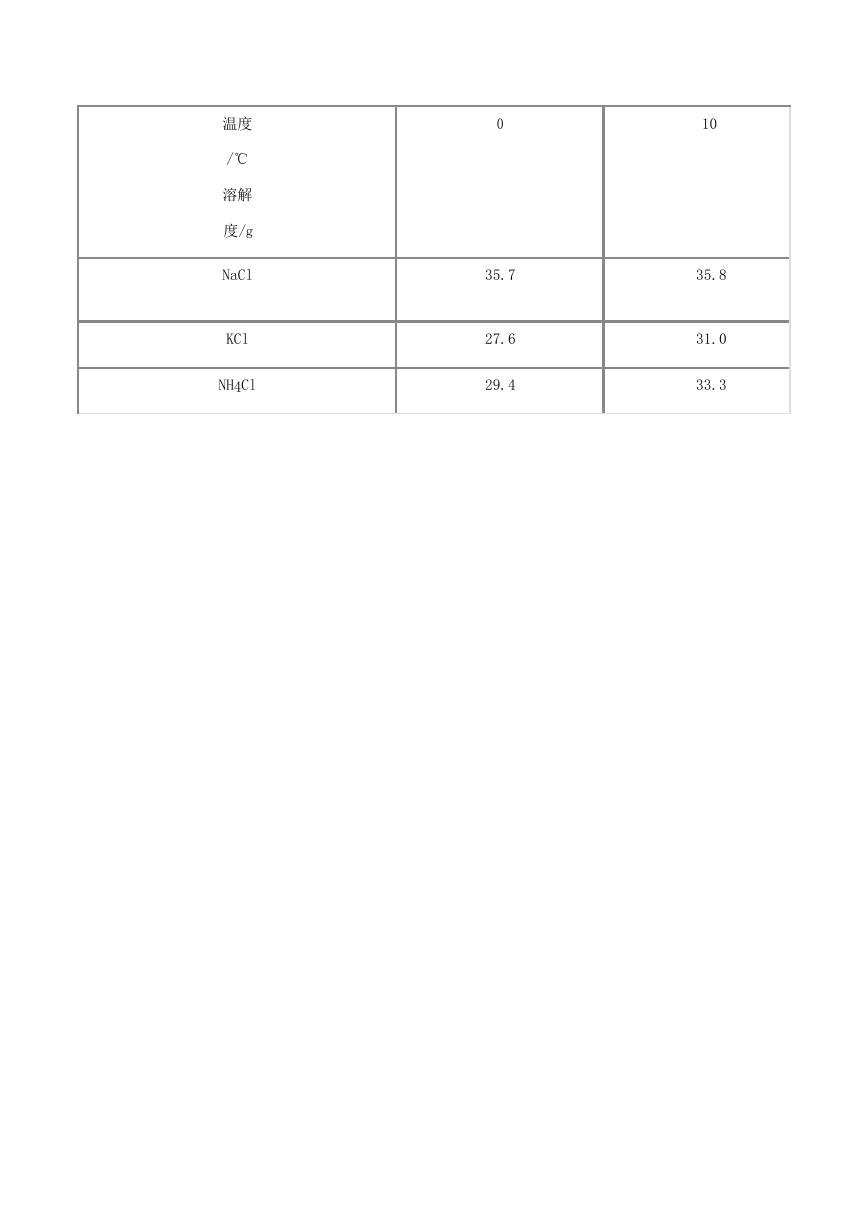
15. 如表是四种物质在不同温度时溶解度表的一部分.下列关于图中圆圈内数据“31.0”的含义正
确的是( )
�
温度
/℃
溶解
度/g
NaCl
KCl
NH4Cl
0
10
35.7
27.6
29.4
35.8
31.0
33.3
�
KNO3
13.3
20.9
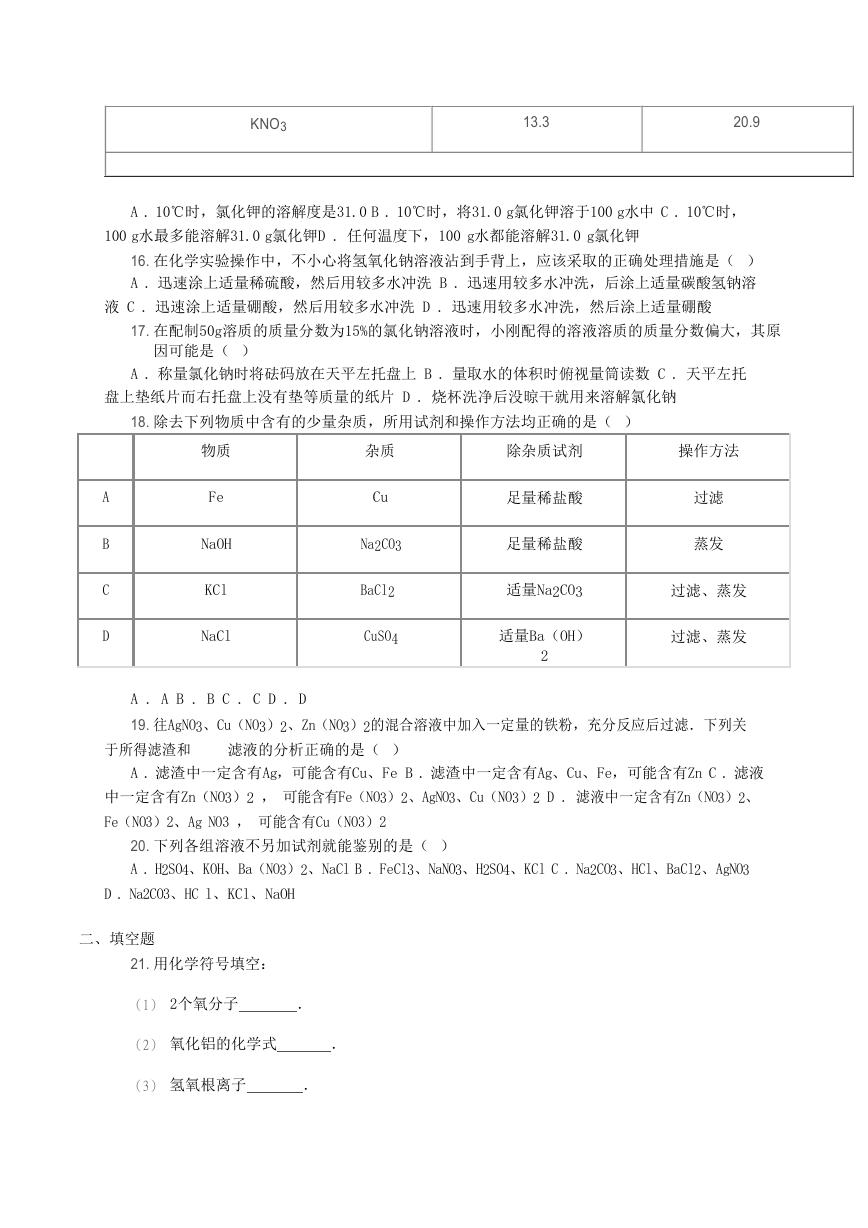
A . 10℃时,氯化钾的溶解度是31.0 B . 10℃时,将31.0 g氯化钾溶于100 g水中 C . 10℃时,
100 g水最多能溶解31.0 g氯化钾D . 任何温度下,100 g水都能溶解31.0 g氯化钾
16. 在化学实验操作中,不小心将氢氧化钠溶液沾到手背上,应该采取的正确处理措施是( )
A . 迅速涂上适量稀硫酸,然后用较多水冲洗 B . 迅速用较多水冲洗,后涂上适量碳酸氢钠溶
液 C . 迅速涂上适量硼酸,然后用较多水冲洗 D . 迅速用较多水冲洗,然后涂上适量硼酸
17. 在配制50g溶质的质量分数为15%的氯化钠溶液时,小刚配得的溶液溶质的质量分数偏大,其原
因可能是( )
A . 称量氯化钠时将砝码放在天平左托盘上 B . 量取水的体积时俯视量筒读数 C . 天平左托
盘上垫纸片而右托盘上没有垫等质量的纸片 D . 烧杯洗净后没晾干就用来溶解氯化钠
18. 除去下列物质中含有的少量杂质,所用试剂和操作方法均正确的是( )
物质
Fe
NaOH
KCl
NaCl
A
B
C
D
杂质
Cu
Na2CO3
BaCl2
CuSO4
除杂质试剂
操作方法
足量稀盐酸
足量稀盐酸
过滤
蒸发
适量Na2CO3
过滤、蒸发
适量Ba(OH)
过滤、蒸发
2
A . A B . B C . C D . D
19. 往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤.下列关
于所得滤渣和
滤液的分析正确的是( )
A . 滤渣中一定含有Ag,可能含有Cu、Fe B . 滤渣中一定含有Ag、Cu、Fe,可能含有Zn C . 滤液
中一定含有Zn(NO3)2 , 可能含有Fe(NO3)2、AgNO3、Cu(NO3)2 D . 滤液中一定含有Zn(NO3)2、
Fe(NO3)2、Ag NO3 , 可能含有Cu(NO3)2
20. 下列各组溶液不另加试剂就能鉴别的是( )
A . H2SO4、KOH、Ba(NO3)2、NaCl B . FeCl3、NaNO3、H2SO4、KCl C . Na2CO3、HCl、BaCl2、AgNO3
D . Na2CO3、HC l、KCl、NaOH
二、填空题
21. 用化学符号填空:
(1) 2个氧分子
.
(2) 氧化铝的化学式
.
(3) 氢氧根离子
.
�
(4) 请标出HClO中氯元素的化合价
.
22. 从①氯化钠、②碳酸氢钠、③稀盐酸、④浓硫酸、⑤硝酸铵、⑥二氧化碳、⑦甲醛溶液、⑧
铜、⑨煤九种物质中, 选择符合下列要求的物质并用其序号填空:
.
(1) 由原子直接构成的是
(2) 常用来制作动物标本的是
(3) 常用作干燥剂的是
(4) 焙制糕点的发酵粉的主要成分是
(5) 常用来灭火的是
(6) 溶于水时使温度明显降低的是
.
.
.
.
.
�
(7) 属于化石燃料的是
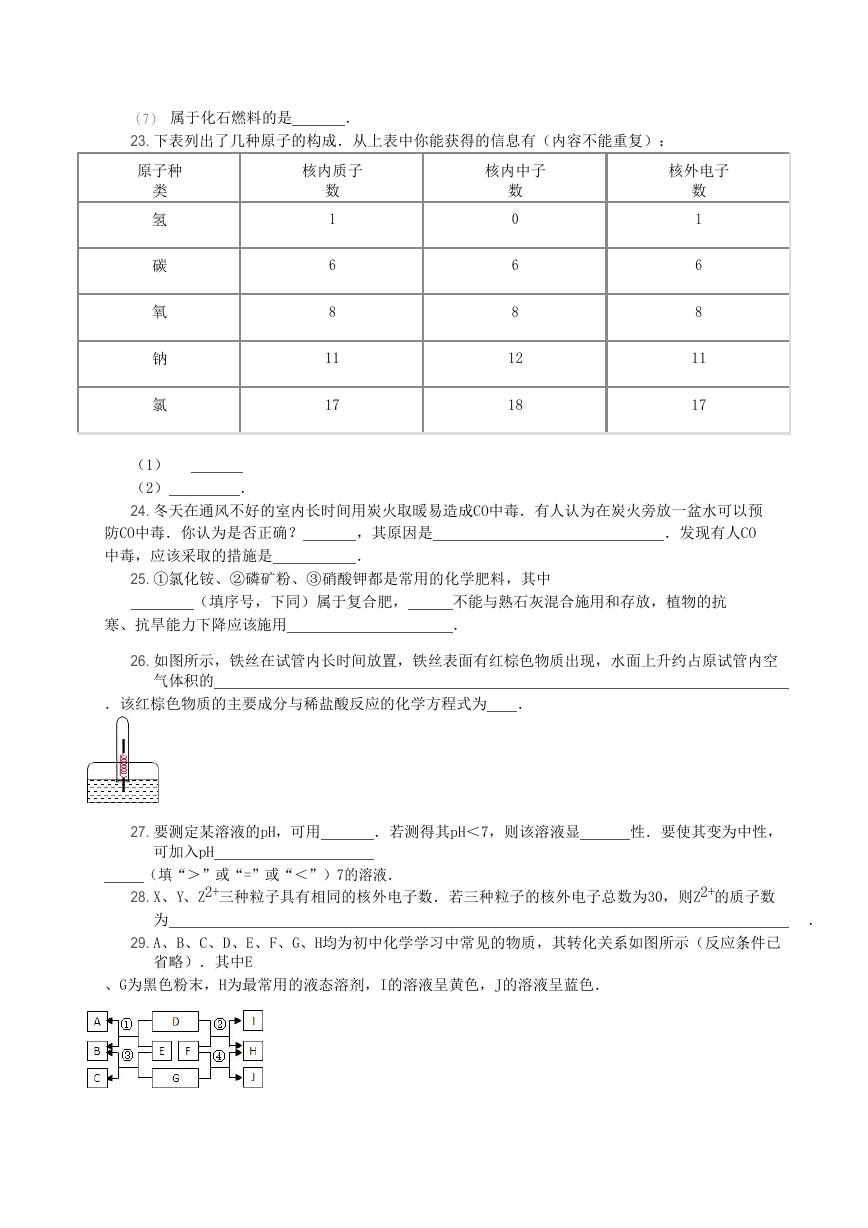
23. 下表列出了几种原子的构成.从上表中你能获得的信息有(内容不能重复):
.
原子种
类
氢
碳
氧
钠
氯
核内质子
数
核内中子
数
核外电子
数
1
6
8
11
17
0
6
8
12
18
1
6
8
11
17
(1)
(2)
24. 冬天在通风不好的室内长时间用炭火取暖易造成CO中毒.有人认为在炭火旁放一盆水可以预
.发现有人CO
.
防CO中毒.你认为是否正确?
中毒,应该采取的措施是
,其原因是
.
25. ①氯化铵、②磷矿粉、③硝酸钾都是常用的化学肥料,其中
(填序号,下同)属于复合肥,
不能与熟石灰混合施用和存放,植物的抗
寒、抗旱能力下降应该施用
.
26. 如图所示,铁丝在试管内长时间放置,铁丝表面有红棕色物质出现,水面上升约占原试管内空
气体积的
.该红棕色物质的主要成分与稀盐酸反应的化学方程式为 .
27. 要测定某溶液的pH,可用
可加入pH
.若测得其pH<7,则该溶液显
性.要使其变为中性,
(填“>”或“=”或“<”)7的溶液.
28. X、Y、Z2+三种粒子具有相同的核外电子数.若三种粒子的核外电子总数为30,则Z2+的质子数
为
.
29. A、B、C、D、E、F、G、H均为初中化学学习中常见的物质,其转化关系如图所示(反应条件已
省略).其中E
、G为黑色粉末,H为最常用的液态溶剂,I的溶液呈黄色,J的溶液呈蓝色.
�
(1) A、C在金属活动性顺序中,
排在
的前面.(填化学式)
(2) 构成E的原子结构示意图为
.写出E的一种用途:
.
(3) 写出反应①的化学方程式:
.写出反应④的化学方程式:
.
三、实验探究题
30. 实验室常用的一些仪器装置如图1所示.
�
(1) 写出下列仪器名称:a
(2) 用稀盐酸(具有挥发性)和石灰石制取CO2 , 应选择装置 (填代号,下同)作发生装
;b
.
置,选装置
作收集装置,反应的化学方程式为
.若要制得纯净、干燥的CO2 , 应在发生装置和收集
装置之间增加图2
所示的装置
置.
和
,其导管口连接顺序是:发生装置→
(填接口序号)→收集装
31. 某实验小组的同学为了研究MnO2在H2O2分解反应中的作用,进行了以下探究:
【查阅资料】①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑,Cl2(氯气)为黄绿色气体,有刺激性气
味.②H2O2溶液为 无色液体,在常温下能缓慢分解放出极少量氧气,在加热或有催化剂存在的条
件下能快速分解出氧气.
【设计实验】在常温下取一定量的H2O2溶液,放置一段时间能看到缓慢放出极少量气泡.加入
4gMnO2粉末后,看到迅速放出大量气泡.不再产生气泡后,将反应后的物质过滤,将滤渣洗涤烘
干,称得其质量为4g.
【分析与结论】
(1) 分析实验现象和有关数据:根据MnO2能
H2O2的分解速率,而本身的
在反应前
后没有改变
,小强认为MnO2在H2O2分解反应中作催化剂.
(2) 根据催化剂的概念,小刚认为以上实验还不足以证明MnO2是H2O2分解反应中的催化剂.他
联系所查资料补做了以下实验,请你帮他完成实验报告:
实验
操作
实验
现象
取实验后的滤渣放入试管中,加
入适量浓盐酸并加热
实验结论
滤渣仍为
MnO2
小刚的实验说明,在H2O2分解反应中MnO2的
不变.综合小强的分析和实验可以确定,
MnO2是H2O2分解反 应的催化剂.
(3) 在实验中,取用MnO2粉末用到的一种仪器是
.用MnO2作催化剂时,H2O2分解的化学方程
式为
.MnO2在上述2个反应中分别作催化剂或反应物,它在某些反应中还可能是生成物,请写出一
�
个它是生成物的化学方程式:
四、计算题
32. 近来有些地方查出在一些饮料中含有违禁添加剂塑化剂.塑化剂的主要成分为邻苯二甲酸
二辛酯,其化学式为C24 H38O4 . 求:
(1) 邻苯二甲酸二辛酯的相对分子质量为
(2) 每个邻苯二甲酸二辛酯分子中含有
(3) 邻苯二甲酸二辛酯中C、H、O元素的质量比为
33. 取KClO3与MnO2的混合物共35g放入试管中,充分加热后剩余固体的质量为25.4g,冷却至室温
溶于适量水中,过滤后得到100g不饱和溶液.往该溶液中滴加AgNO3溶液至恰
个氧原子.
.
.
后,将该剩余固体
好不再产生沉淀,共用去130.7g
AgNO3溶液.问:
g.
(1) 产生O2的质量为
(2) 生成KCl的质量为
(3) 最后所得溶液中溶质的质量分数为多少?(请写出计算过程)
g.
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc