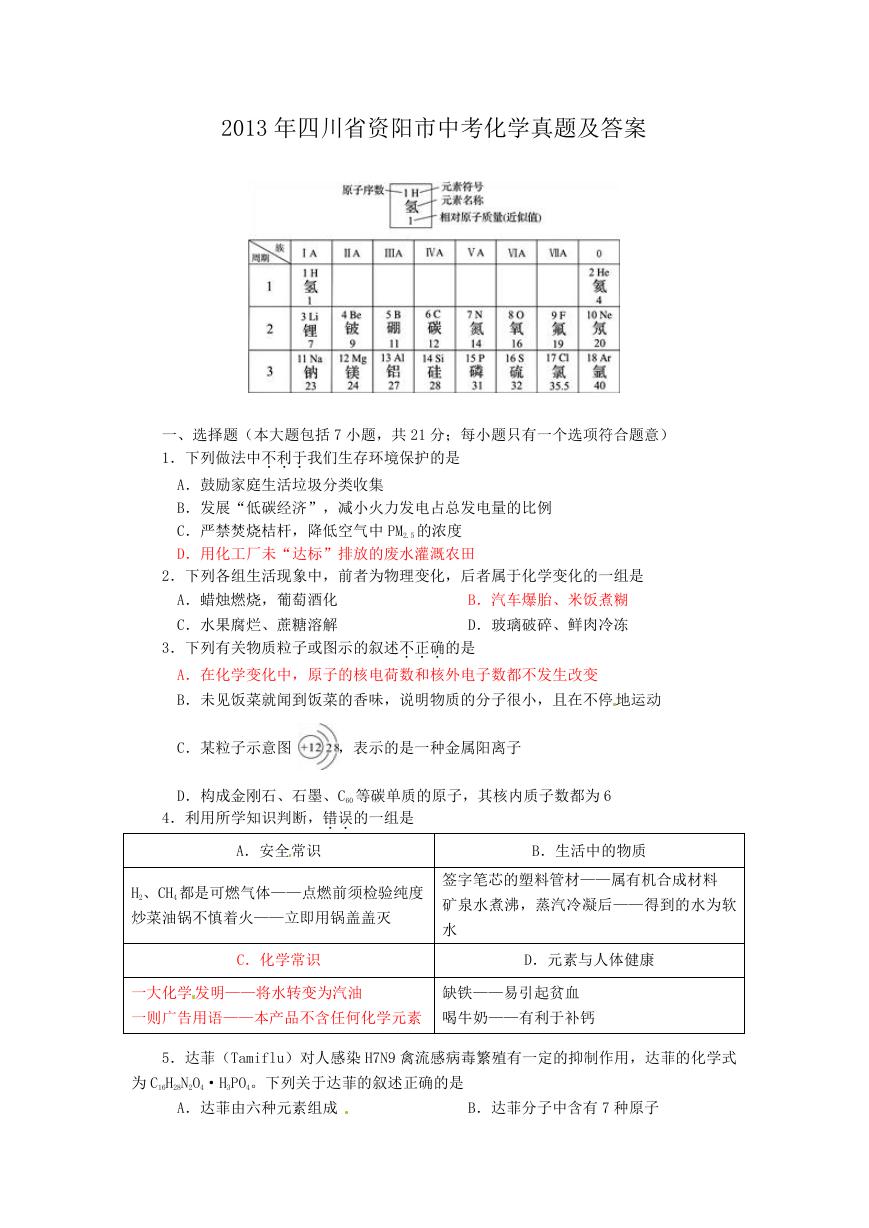
2013 年四川省资阳市中考化学真题及答案
一、选择题(本大题包括 7 小题,共 21 分;每小题只有一个选项符合题意)
1.下列做法中不利于...我们生存环境保护的是
A.鼓励家庭生活垃圾分类收集
B.发展“低碳经济”,减小火力发电占总发电量的比例
C.严禁焚烧桔杆,降低空气中 PM2.5 的浓度
D.用化工厂未“达标”排放的废水灌溉农田
2.下列各组生活现象中,前者为物理变化,后者属于化学变化的一组是
A.蜡烛燃烧,葡萄酒化
C.水果腐烂、蔗糖溶解
B.汽车爆胎、米饭煮糊
D.玻璃破碎、鲜肉冷冻
3.下列有关物质粒子或图示的叙述不正确...的是
A.在化学变化中,原子的核电荷数和核外电子数都不发生改变
B.未见饭菜就闻到饭菜的香味,说明物质的分子很小,且在不停 地运动
C.某粒子示意图
,表示的是一种金属阳离子
D.构成金刚石、石墨、C60 等碳单质的原子,其核内质子数都为 6
4.利用所学知识判断,错误..的一组是
A.安全常识
B.生活中的物质
H2、CH4 都是可燃气体——点燃前须检验纯度
炒菜油锅不慎着火——立即用锅盖盖灭
签字笔芯的塑料管材——属有机合成材料
矿泉水煮沸,蒸汽冷凝后——得到的水为软
水
C.化学常识
D.元素与人体健康
一大化学 发明——将水转变为汽油
缺铁——易引起贫血
一则广告用语——本产品不含任何化学元素
喝牛奶——有利于补钙
5.达菲(Tamiflu)对人感染 H7N9 禽流感病毒繁殖有一定的抑制作用,达菲的化学式
为 C16H28N2O4·H3PO4。下列关于达菲的叙述正确的是
A.达菲由六种元素组成
B.达菲分子中含有 7 种原子
�
C.达菲中氮元素的质量分数为 50%
D.达菲中氮、磷两种元素的质量比为 28∶31
6.t ℃时,向一支盛有 0.15 g 熟石灰的烧杯中加入 50 g 水,充分振荡后静置,烧杯
底部仍有未溶解的白色固体。下列相关叙述正确的是
A.升高温度上层清液变为不饱和溶液
B.t ℃时,熟石灰的溶解度为 0.3 g
C. 烧杯中溶液的质量小于 50.15 g
D.上层清液中溶质质量分数大于 0.3%
7.下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中肯定错误..的是
A.加热一定量碳铵(NH4HCO3)的实验,试管中固体的 质量变化
B.等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化
C.向一定质量的水中加入氢氧化钠时,形成的溶液 pH 的变化
D.向盛有一定量 Ba(OH)2 溶液的烧杯中逐滴滴加稀硫酸,测得烧杯中溶液导电性的
变化
二、填空 题(本大题包括 6 小题,共 24 分)
8.(3 分)对河水水样净化时,先向水样中加入絮凝剂,反应,沉降,然后通过 过滤
(填一种实验基本操作)除去难溶性杂质;用 pH 试纸测得水样 pH 为 5.9,则河水显 酸 性。
若水厂用此河水作水源,经一系列净化处理、投放含 ClO2 的药液后才能出厂进入管网作为
生活用水,投放药液的目的是 消毒 。
9.(4 分)按要求完成下列各题:
(1)现有 H、C、O、Ca、Fe 五种元素,选择其中一种或几种元素组成符合下列要求的
物质,并用化学式填 空:分子量最小的氧化物 H2O;制二氧化碳的石灰石的主要成分 CaCO3 。
(2)高铁酸钾(K2FeO4)是一种“绿色”环保高效净水剂,可由如下反应制得:Fe2O3 +
3X + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O,则 X 的化学式为 KNO3,K2FeO4 中 Fe 的化合价为 +6 。
高温
10.(4 分)事物都具有两面性。如:CO 可作冶金工业原料,却对人体健康有害;O2
可用于急救病人, 维持生命活动需要,却参与钢铁的锈蚀过程。
(1)写出高炉炼铁中 CO 还原氧化铁的化学反应方程式:Fe2O3+3CO
2Fe+3CO2;煤
气中毒是因为 CO 与血液中 血红蛋白结合,造成人体缺氧。
(2)钢铁制品在潮湿的空气中易生锈;钢和生铁都是铁与 碳 元素形成的合金,由
于该元素含量的不同,使得钢和生铁的坚韧性有较大差异。
11.(3 分)向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,
向滤液中插入铁片,有气泡产生,则滤渣中一定含有 铜 ;氧化铜与稀硫酸反应的化学反
应方程式为 CuO+H2SO4
CuSO4+H2O 。实验室用浓硫酸配制一 定量的稀硫酸,正确操作是
将浓硫酸沿器壁缓慢倒入水中,并不断搅拌。
12.(4 分)某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观
察到的现象如下表所示。
�
试剂 稀盐酸
食醋
蔗糖水 蒸馏水 肥皂水 烧碱溶液 石灰水
颜色
红
红
黄
黄
绿
绿
绿
请分析上表,并回答下列问题:
(1)该花汁 可以 (填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质 ),使皮肤红肿、痛痒。要缓解这种症状,
简易可行的办法是在叮咬处涂抹上述试剂中的 肥皂水 。
(3)胃酸的主要成分是盐酸,胃舒平(主要成分 Al(OH)3)和小苏打常用于治疗胃酸过
多症 ,写出小苏打治疗胃酸过多症时的化学反应方程式 NaHCO3+ HCl==NaCl+H2O+CO2↑。
( 4 ) 石 灰 水 暴 露 于 空 气 中 易 变 质 , 写 出 变 质 反 应 的 化 学 方 程 式 : Ca(OH)2+CO2 =
CaCO3↓+H2O。
13.(6 分)含硫的物质 在实验室或工业生产过程中可出现下列图示的转化:
(1)实验室中,单质硫是淡黄色固体,点燃少量单质硫于充满氧气的集气瓶中燃烧,
产生漂亮的蓝紫色火焰,生成物质 A。
(2)A 是工业排放物中一种主要的空气污染物,也是酸雨形成的主因之一。根据你学
过的知识可将 A 转化成 Na2SO3,你提供的试剂是 NaOH 溶液。
(3)在硫酸工业中,将 A 在一 定条件下与空气中的物质反应得到 B,B 与水结合得到
硫酸。B 与 A 的组成元素相同,B 中硫元素与硫酸中硫元素化合价相同,写出 A 转化成 B 的
化学方程式: 2SO2+O2==2SO3 。实验室测定,B 与水结合时温度升高,则反应④为 放热反
应(选填“吸热”或“放热”)。
(4)上述物质转化过程中,属于化合反应的是①③④(填序号)。
(5)若回收工业排放物 A 32 吨,理论上可生产硫酸 49 吨。
三、实验与探究题(本大题包括 2 小题, 共 10 分)
14.(4 分)化 学仪器是化学实验的条件保障。现有下列仪器:a.试管、b.集气瓶、
c.锥形瓶、d.长颈漏斗、e.酒精灯、f.量筒、g.水槽、h.烧杯、i.药匙、j.导管(带胶塞),
根据下列实验选取仪器(选填仪器字母)或补充仪器(填仪器名称)。
(1)配制质量分数为 6%的氯化钠溶液,上述仪器要用到的有 fhi,必须补充的仪器是
托盘天平、胶头滴管、玻璃棒 。
(2)用高锰酸 钾制取、并用排水法收集氧气时,上述仪器要用到的有:abegij,还需要
的仪器是玻璃片。
15.(6 分)课本中有一问:为什么汗水有咸味?学习小组同学为此开展探究。
【提出问题】汗水中产生咸味的物质是什么?
【假设与猜想】根据生活经验推测,汗水中产生咸味的物质可能是 NaCl 。
【查阅资料】用铂丝醮取少许含有钠元素的溶液(或物质)在酒精 灯火焰上灼烧,会
呈现黄色火焰。
�
【制订计划】为了证明咸味物质是猜想中的 物质,一是要证明汗水溶液中含有阴离
子 Cl- (填写离子符号),二是要证明汗水溶液中有阳离子 Na+ (填写离子符号)。
【进行实验】
证明阴离子的实验:向汗水溶液中滴加硝酸银(或 AgNO3)溶液,再加入少量稀硝酸,振荡,
仍有白色沉淀产生。
证明阳离子的实验:用铂丝醮取少许汗水,在酒精灯火焰上灼烧;若火焰为黄色,则汗水中
含 Na+.
【结 论】经上述实验证明,汗水中的咸味物质就是猜想中的物质。
【分析与交流】上述实验中,证明阴离子存在的化学反应方程式 NaCl+AgNO3==AgCl↓
+NaNO3,该反应属于复分解反应。
四、计算 题(本大题包括 1 小题,共 5 分)
16.(5 分)将 8.0 g 氢氧化钠完全溶于水形成溶液,向其中加入一定质量的硫酸铜溶
液,恰好完全反应,所得混合物总质量为 1 09.8 g(铜的相对原子 质量为 64)。计算:
(1)反 应产生沉淀的质量。
(2)反应后所得溶液的溶质质量分数。
解: 设反应后生成氢氧化铜沉淀 xg,硫酸钠 yg。
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
80
8.0g
98
xg
142
yg
80:98=8.0g:xg.
80:142=8.0g:yg
解得 x=9.8
y=14.2
反应后硫酸钠溶液的质量:109.8g-9.8g=100g
反应后硫酸钠溶液中的溶质的质量分数:
g2.14
g100
×100%=14.2%
答:反应产生沉淀 9.8g,反应后溶液中溶质质量分数为 14.2%。
�







 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc